Inquadramento
Lo studio CANTOS, pubblicato tre anni fa, ha dimostrato come l’inibizione di interleukina(IL) -1beta con canakinumab in pazienti con storia di infarto miocardico e valori di proteina C reattiva (PCR) >2 mg/L porti ad una riduzione degli eventi clinici cardiovascolari senza interferire con i valori di colesterolemia ad un follow-up medio di 3.7 anni[1]Ridker PM, Everett BM, Thuren T, et al. Antiinflammatory therapy with canakinumab for atherosclerotic disease. N Engl J Med 2017;377:1119-1131.. I risultati, benché significativi, hanno lasciato molti dubbi sia per la modesta rilevanza clinica (una riduzione di infarto miocardico di 0.5% e nessun effetto sulla mortalità cardiovascolare) che per la concomitanza di effetti collaterali non trascurabili (aumento di mortalità per cause di natura infettiva e sepsi). Nell’analisi presente gli Autori verificano gli effetti della terapia sui valori di due citochine, IL-6 e IL-18, che una serie di studi ha implicato come potenziali fattori patogenetici nella progressione della malattia aterosclerotica.
Lo studio in esame
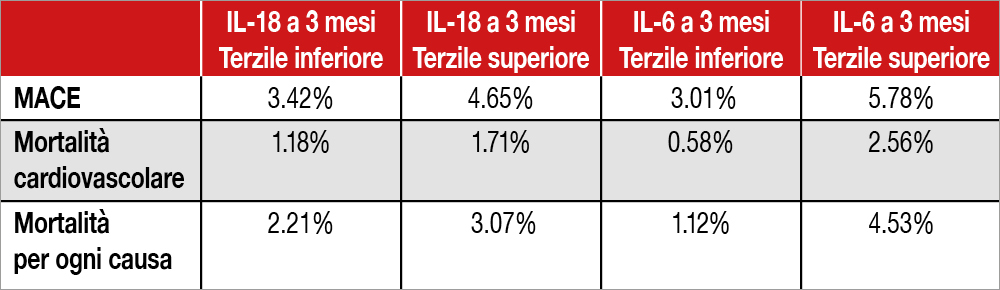
Gli Autori segnalano come canakinumab abbia ridotto, rispetto al placebo, in modo dose[1]dipendente, i valori di IL-6 a tre mesi sino al 43% del valore basale, mentre nessuna variazione si sia osservata per IL-18. Più alti i valori a tre mesi di queste citochine, progressivamente maggiore risultava l’incidenza di eventi cardiovascolari maggiori, inclusa la morte cardiovascolare e la mortalità totale (Tabella). Segnalato anche un effetto addizionale di valori elevati di IL-6 e IL-18 sugli eventi osservati: i pazienti con livelli elevati di entrambe le citochine avevano la prognosi peggiore. Questi dati dimostrano quindi la persistenza, nonostante l’inibizione di IL-1beta, di una residua componente infiammatoria che si correla in modo significativo con gli eventi futuri.
Take home message
La mancata riduzione dei valori di IL-18 da parte di canakinumab, associata in taluni pazienti a valori persistentemente elevati di IL-6 nonostante la terapia, comportano una elevata incidenza di eventi avversi nel follow-up. È necessario sviluppare perciò molecole che siano in grado di ridurre in modo ancor più drastico i livelli di IL-6 e contemporaneamente ridurre quelli di IL-18. Questa opportunità terapeutica potrebbe avverarsi con l’utilizzo degli inibitori orali dell’inflammasoma NLRP-3, che ha un ruolo cruciale nei processi infiam[1]matori che portano al rilascio di IL-6 e IL-18.
Commento
Lo studio CANTOS è importante, non tanto per le ricadute cliniche attualmente irrilevanti, ma perché è stata la prima “proof of concept” che una diminuzione dello stato infiammatorio (espresso dai valori di PCR e IL-6) riduca gli eventi cardiovascolari nei pazienti con esiti di infarto miocardico. L’analisi di Ridker sembra aprire la via alla sperimentazione di nuovi agenti che ancor più drasticamente riducano l’IL-6 e che inoltre incidano anche su quelli di IL-18. Benché queste considerazioni aprano orizzonti terapeutici (inibitori dell’inflammasoma NLRP-3) da testare con grande interesse, il clinico non può che essere molto perplesso: ad esempio, mentre i valori di IL-6 si riducono all’aumentare della dose di canakinumab, così non è stato per gli eventi clinici osservati nello studio CANTOS. Non è perciò scontato che una ulteriore riduzione di IL-6 si debba associare ad una riduzione degli eventi avversi nel follow-up. Vi è anche da tener conto che valori elevati di citochine, in particolare di IL-6, si associano a condizioni di scompenso cardiaco (spesso correlato ad un pregresso evento infartuale), ma tutti gli studi che hanno cercato di ridurne i valori in questa condizione clinica hanno dato esito negativo[2]Abbate A, Van Tassell BW, Biondi-Zoccai G, et al. Effects of interleukin-1 blockade with anakinra on adverse cardiac remodeling and heart failure after acute myocardial infarction. Am J Cardiol … Continua a leggere. Infine, bisognerà sempre valutare i possibili effetti collaterali, in particolare quelli di natura infettiva, associati a terapie che riducono in modo drastico le citochine plasmatiche.
L’opinione di Alberto Margonato e Michela Cera
Università Vita-Salute S. Raffaele-UO Cardiologia Clinica OSR-Milano
Questa sottoanalisi dello studio CANTOS sui biomarcatori pro-infiammatori dimostra che canakinumab induce una significativa inibizione dei livelli plasmatici di IL-6 ma non della IL-18. Lo studio mostra inoltre come i livelli basali di IL-6 e IL-18 (pretrattamento con canakinumab) predicano il rischio di eventi cardiovascolari ricorrenti (MACE, morte cardiaca, morte, re-PCI) e come tale effetto avverso sia additivo tra i due biomarkers. Questo lavoro è importante non solo perché ci consente di comprendere i meccanismi di inibizione dell’infiammazione associati a canakinumab, ma anche per lo sviluppo futuro di nuovi agenti antinfiammatori mirati all’aterotrombosi. Sappiamo che l’inflammasoma NLRP-3 (che sono complessi multiproteici intracellulari che si assemblano in risposta a patterns molecolari associati ad agenti patogeni o a un danno cellulare o tissutale di varia natura) attiva sia IL-1 che IL-18; quindi gli agenti orali in fase di sviluppo che prendono di mira direttamente questo inflammasoma dovrebbero abbassare entrambe queste citochine pro-infiammatorie, potenziando cosi l’effetto del canakinumab (che non riduce l’azione sfavorevole della IL-18). Tuttavia, appare chiaro che il rischio infiammatorio residuo sia prima che dopo trattamento con canakinumab è assolutamente maggiore per valori elevati di IL-6 che per IL-18. Questa osservazione fornisce supporto per un potenziale uso di terapie anti-citochine che inibiscono selettivamente l’IL-6. Dati pregressi confermano che i livelli di IL-6 si associano a un aumentato rischio cardiovascolare sia in prevenzione primaria sia in quella secondaria. Infatti, nello studio CANTOS, i pazienti con modesta riduzione dei valori di IL-6 dopo canakinumab rimangono ad elevato rischio di eventi cardiovascolari rispetto a quelli con riduzione più significative di IL-6[3]Kaptoge S, Seshasai SR, Gao P, et al. Inflammatory cytokines and risk of coronary heart disease: new prospective study and updated meta-analysis. Eur Heart J 2014;35:578-589.[4]IL6R Genetics Consortium Emerging Risk Factors Collaboration. Interleukin-6 receptor pathways in coronary heart disease: a collaborative meta-analysis of 82 studies. Lancet 2012;379:1205-1213.[5]Ridker PM, Libby P, MacFadyen JG, et al. Modulation of the interleukin-6 signalling pathway and incidence rates of atherosclerotic events and all-cause mortality: analyses from the Canakinumab … Continua a leggere.
Occorreranno altri studi per confermare che questi effetti antinfiammatori siano persistenti nel tempo, dosando i livelli plasmatici di tali citochine ben oltre i 3 mesi dalla somministrazione del canakinumab, come invece finora osservato. Infine, è chiaro che queste evidenze scientifiche necessitano di conferme in ambito clinico in popolazioni più ampie prima di poter ipotizzare un utilizzo clinico in larga scala in prevenzione primaria e secondaria.
Bibliografia[+]
| ↑1 | Ridker PM, Everett BM, Thuren T, et al. Antiinflammatory therapy with canakinumab for atherosclerotic disease. N Engl J Med 2017;377:1119-1131. |
|---|---|
| ↑2 | Abbate A, Van Tassell BW, Biondi-Zoccai G, et al. Effects of interleukin-1 blockade with anakinra on adverse cardiac remodeling and heart failure after acute myocardial infarction. Am J Cardiol 2013;111:1394-1400. |
| ↑3 | Kaptoge S, Seshasai SR, Gao P, et al. Inflammatory cytokines and risk of coronary heart disease: new prospective study and updated meta-analysis. Eur Heart J 2014;35:578-589. |
| ↑4 | IL6R Genetics Consortium Emerging Risk Factors Collaboration. Interleukin-6 receptor pathways in coronary heart disease: a collaborative meta-analysis of 82 studies. Lancet 2012;379:1205-1213. |
| ↑5 | Ridker PM, Libby P, MacFadyen JG, et al. Modulation of the interleukin-6 signalling pathway and incidence rates of atherosclerotic events and all-cause mortality: analyses from the Canakinumab Anti-Inflammatory Thrombosis Outcomes Study (CANTOS). Eur Heart J 2018;39:3499-3507. |
Accedi per leggere tutto l'articolo
Inserisci i dati del tuo account su Cardiotalk per accedere e leggere tutto il contenuto dell'articolo.
Se non hai un account, clicca sul pulsante registrati e verrai reindirizzato al portale Cardiotalk per la registrazione.

