Inquadramento
È noto che gli eventi emorragici clinicamente manifesti che causino una discesa di emoglobina (Hb), superiore ad almeno 3 g/dL nei pazienti con sindrome coronarica acuta (ACS), si accompagnino a un un rischio di mortalità a distanza[1]Valgimigli M, Costa F, Lokhnygina Y, et al. Trade-off of myocardial infarction vs. bleeding types on mortality after acute coronary syndrome: lessons from the Thrombin Receptor Antagonist for … Continua a leggere. Non è chiaro invece se una riduzione di emoglobina, in assenza di un evento emorragico accertato, abbia lo stesso peso prognostico.
Lo studio in esame
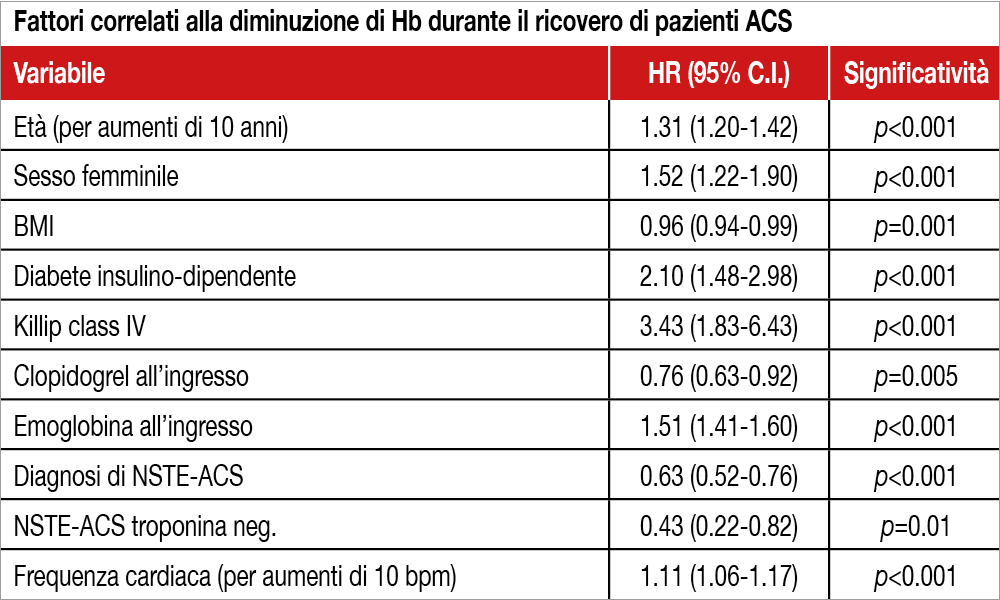
Rivisitazione del trial MATRIX, studio italiano che ha arruolato oltre 8.000 pazienti con ACS sottoposti ad angioplastica coronarica (PCI) con lo scopo di verificare se una riduzione dei valori di emoglobina durante l’ospedalizzazione si accompagni a un rischio di mortalità indipendentemente dal fatto che essa si accompagni o meno a un evento emorragico clinicamente ben definito. Una riduzione di Hb si è verificata nell’83.6% dei pazienti (di cui oltre il 90% <3 g/dL). Una perdita di Hb maggiore (>5 g/dL) o minore (tra 3 e 5 g/dL) si è globalmente prodotta nell’8.5% dei casi, in assenza di bleeding clinicamente manifesto in oltre due terzi dei pazienti (72%). I predittori indipendenti di una perdita di emoglobina maggiore o minore sono espressi nella Tabella. I pazienti con perdita di Hb di grado minore o maggiore, pur in assenza di un evento emorragico clinicamente definito, avevano un maggior rischio di mortalità a 1 anno rispetto a quelli senza riduzione di Hb (rispettivamente HR: 2.37; 95% CI 1.32- 4.24 e HR: 2.58; 95% CI: 0.98-6.78). All’analisi multivariata l’HR, associato alla perdita di ogni grammo di Hb, risultava 1.18 (95% CI: 1.04-1.34) in assenza di bleeding manifesto e 1.41 (95% CI: 1.19-1.67) in presenza di bleeding.
Take home message
Nei pazienti con ACS sottoposti a PCI una riduzione di Hb di almeno 3 g/dL durante il ricovero si associa a un rischio di mortalità maggiore a un anno di follow-up, indipendentemente dal fatto che si accompagni a un evento emorragico clinicamente manifesto. Questi dati, se confermati, permettono di identificare una popolazione ad alto rischio e dovrebbero contribuire a modificare la definizione attuale di bleeding.
Prospettive future
Il dato che la riduzione di emoglobina costituisca un fattore di rischio di per sè, indipendentemente dal fatto che si associ o meno a un evento emorragico definito, può essere definito un cambiamento di paradigma nella analisi dei fattori prognostici delle ACS. Lo studio può aprire, quindi, la strada ad altre indagini che verifichino quali sono i fattori che determinano in questi pazienti la perdita di emoglobina, che risulta occulta nella maggior parte dei casi. Gli Autori suggeriscono, come possibili cause, uno stato infiammatorio intenso, una policitemia da stress all’ingresso, una emodiluizione per un sovraccarico di liquidi durante la degenza. Interessante il dato della Tabella, che mostra come fattori protettivi sulla diminuzione di Hb all’ingresso, la diagnosi di non-ST elevation ACS (soprattutto se troponina negativi) e la presenza di clopidogrel nella terapia del paziente al ricovero. Aspetti che meritano un approfondimento da studi futuri.
L’opinione di Nuccia Morici e Silvia Cantoni
Intensive Cardiac Care Unit, De Gasperis Cardio Center and Hematology Department, ASST Grande Ospedale Metropolitano Niguarda, Milano
L’iniziativa promossa dall’“Academic Research Consortium” ha identificato nel 2019 i criteri per definire un incremento del rischio emorragico nei pazienti sottoposti a PCI[2]Urban P, Mehran R, Colleran R et al. Defining high bleeding risk in patients undergoing percutaneous coronary intervention: a consensus document from the Academic Research Consortium for High … Continua a leggere. Valori basali di Hb <11 gr/dL sono stati considerati un criterio maggiore, mentre valori basali di Hb tra 11 e 12.9 g/dL per gli uomini e 11 e 11.9 g/dL per le donne sono stati considerati un criterio minore. La definizione del rischio emorragico è importante per identificare le più idonee strategie di trattamento nel follow-up a breve e medio-lungo termine. Tuttavia, questo approccio presuppone che il ruolo dell’anemia nell’influenzare sfavorevolmente l’outcome derivi esclusivamente dall’effetto dell’anemia sugli eventi emorragici e dell’effetto sfavorevole di un evento emorragico sulla mortalità totale e sugli eventi cardiovascolari maggiori (infarto miocardico ricorrente e ictus cerebrale).
La letteratura ha in realtà consistentemente dimostrato che i valori basali di emoglobina hanno un effetto prognostico indipendente, probabilmente per l’effetto amplificatore sull’insulto ischemico e per la discrepanza tra apporto di O2 e suo consumo in corso di ACS[3]Sabatine MS, Morrow DA, Giugliano RP, et al. Association of hemoglobin levels with clinical outcomes in acute coronary syndromes. Circulation 2005;111:2042–9.. Il lavoro di Leonardi et al. espande questo concetto, attribuendo alla riduzione dei valori di Hb in corso di ricovero per ACS un ruolo prognostico indipendente rispetto al sanguinamento clinicamente manifesto. Quale può essere la spiegazione fisiopatologica di questa associazione? Per provare a dare una risposta, bisogna fare un passo indietro e considerare l’anemia in un contesto più ampio. Ricordiamo che gli eritrociti hanno una emivita di circa 120 giorni e in circolo sono presenti sia reticolociti appena prodotti dal midollo emopoietico sotto stimolo proliferativo indotto dall’eritropoietina, sia emazie al termine del loro ciclo vitale. Lo steady state – che determina i valori finali di Hb – si mantiene fintanto che ogni emazia senescente viene “rimpiazzata” da un reticolocita. In presenza di una patologia sistemica grave la produzione di eritropoietina da parte del rene subisce un brusco arresto e questo si traduce in una ridotta reticolocitosi, motivo per cui si sviluppa anemia: l’anemia della malattia cronica. In realtà, perchè si blocchi l’eritropoiesi non è affatto necessario che il processo sia cronico: bastano pochi giorni e per questo è preferibile parlare di anemia associata all’immunoflogosi. Ne deriva che in presenza di ACS (= attivazione della risposta di fase acuta) immediatamente l’eritropoietina non viene più adeguatamente prodotta: gli eritrociti senescenti continuano a essere eliminati e i reticolociti si riducono drasticamente. Se questo sbilanciamento è consistente e persiste nel tempo, il risultato finale è una riduzione dell’Hb. In ambito cardiologico poi, sulla valutazione dell’Hb incide il bilancio idrico, cioè la ritenzione per deficit di pompa da un lato, l’utilizzo di diuretici dall’altro. In presenza dell’attivazione dell’immunoflogosi che si associa ad ACS, si può dire qualcosa sull’anemia solo se si raccolgono dati anche su andamento di eritropoietina e reticolociti che consentono di valutare il contributo della componente ipoproliferativa nella genesi dell’anemia. In questo contesto fisiopatologico, il valore di Hb può essere interpretato come un marcatore dello stato di “well-being” complessivo del paziente e, se vogliamo dare un significato prognostico a lungo termine, ben sappiamo come l’anemia sia la spia della fragilità del paziente. Se il paziente produce pochi reticolociti in fase acuta e continua a non farne abbastanza dopo la dimissione (= reticolocitosi inadeguata al grado di anemia) e non recupera i valori di Hb, significa che persiste un “blocco” a monte dell’eritropoiesi, sempre ammesso che non ci sia anche una patologia primitiva del midollo emopoietico o comunque una condizione di ipoplasia midollare para-fisiologicamente legata all’età. Se consideriamo questi aspetti, l’interpretazione dell’anemia e del suo ruolo prognostico implica uno shift di paradigma, che reinterpreta il valore basale di Hb ed eventuali riduzioni “non compensate” in funzione della storia clinica più recente del paziente, una vera “Hb glicata” della sua fragilità biologica preesistente. Pertanto, un inquadramento corretto dei livelli di emoglobina in corso di ACS non può non tenere conto della valutazione degli eventi clinici immediatamente antecedenti il ricovero, indice che hanno condizionato l’eritropoiesi.
Bibliografia[+]
| ↑1 | Valgimigli M, Costa F, Lokhnygina Y, et al. Trade-off of myocardial infarction vs. bleeding types on mortality after acute coronary syndrome: lessons from the Thrombin Receptor Antagonist for Clinical Event Reduction in Acute Coronary Syndrome (TRACER) randomized trial. Eur Heart J 2017;38:804–10. |
|---|---|
| ↑2 | Urban P, Mehran R, Colleran R et al. Defining high bleeding risk in patients undergoing percutaneous coronary intervention: a consensus document from the Academic Research Consortium for High Bleeding Risk. Eur Heart J. 2019;40:2632- 2653. doi: 10.1093/eurheartj/ehz372. |
| ↑3 | Sabatine MS, Morrow DA, Giugliano RP, et al. Association of hemoglobin levels with clinical outcomes in acute coronary syndromes. Circulation 2005;111:2042–9. |
Accedi per leggere tutto l'articolo
Inserisci i dati del tuo account su Cardiotalk per accedere e leggere tutto il contenuto dell'articolo.
Se non hai un account, clicca sul pulsante registrati e verrai reindirizzato al portale Cardiotalk per la registrazione.

