Stefano De Servi, Università degli Studi di Pavia
Inquadramento
Le raccomandazioni delle Linee Guida si basano sull’evidenza proveniente da studi randomizzati (RCT) che hanno testato varie ipotesi strategiche e terapeutiche. Tuttavia, per essere estese a tutti i pazienti, le Linee Guida devono basarsi su studi che abbiano una ampia rappresentatività dei pazienti incontrati nel mondo reale. È noto, invece, che alcune tipologie di pazienti non sono inclusi negli studi randomizzati, soprattutto soggetti di sesso femminile e anziani.
Lo studio in esame
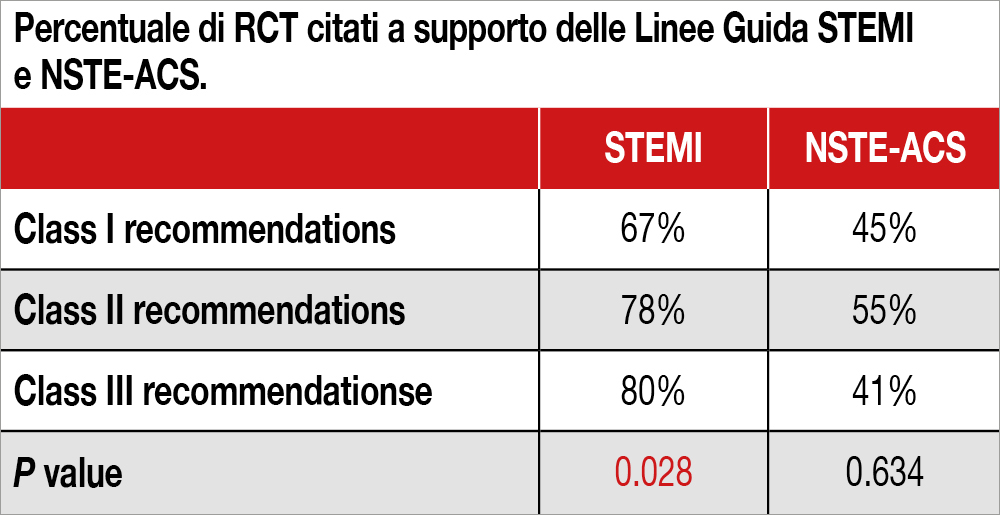
Gli Autori hanno verificato le voci bibliografiche (n=2.128, di cui il 19.1% RCT) citate nelle Linee Guida europee e nord-americane (600 raccomandazioni) relative alle sindromi coronariche acute (ACS), sia non-ST elevation (NSTE) che STEMI. I RCT considerati avevano incluso prevalentemente pazienti nord americani o europei (73.2%) con una minore rappresentanza di pazienti asiatici (25.3%). Inoltre, poco più di due terzi degli studi citati (68.6%) avevano arruolato pazienti ACS, mentre il restante 31.4% non ne aveva arruolato neppure uno; anzi, il 19.1% degli studi escludeva i pazienti ACS (pur tuttavia il 14% delle raccomandazioni di classe I era basata su studi che non includevano pazienti ACS). La percentuale di RCT che hanno arruolato pazienti STEMI per le Linee Guida STEMI erano significativamente minori per la classe di raccomandazione I rispetto a II e III, mentre si osservava nessuna differenza per i pazienti NSTE-ACS (vedi Tabella). L’età media dei pazienti arruolati era 62 anni (il 23.2% degli studi escludeva pazienti al di sopra di un prefissato limite di età), così pure erano sottorappresentati i pazienti di sesso femminile (29.9%) e le minoranze etniche (<20%). Nei pazienti STEMI quelli sottoposti a fibrinolisi erano tre volte più rappresentati dei pazienti sottoposti a PCI primaria. La mortalità per ogni causa, riportata nei vari trial, appare più alta di quella osservata nel mondo reale (11.9% a 1 anno).
Take home message
I RCT che supportano le raccomandazioni delle Linee Guida ACS non rappresentano la globalità e la tipologia dei pazienti incontrati nel mondo reale. La modalità di riperfusione riportata nella maggior parte dei RCT che abbiano incluso pazienti STEMI (fibrinolisi), non è quella attualmente utilizzata nella pratica clinica.
Interpretazione dei dati
Lo studio è interessante, anche se molte delle osservazioni raccolte sono già state oggetto di presentazione e discussione. Una sottorappresentazione di donne e di pazienti anziani nei trial è universalmente nota. Un’analisi recente, condotta su 460 trial pubblicati in 8 riviste ad alto impatto tra il 2001 e il 2018, ha mostrato come l’età media dei pazienti arruolati risultò essere di 62,9 anni, simile a quella ottenuta nello studio presente[1]Tahhan AS, Vaduganathan M, Greene SJ, et al. Enrollment of Older Patients, Women, and Racial/Ethnic Minority Groups in Contemporary Acute Coronary Syndrome Clinical Trials: A Systematic Review. JAMA … Continua a leggere. Tuttavia, fu osservato un aumento dell’età media tra gli studi effettuati tra il 2001 e il 2006 (età media 62.4 anni) e quelli condotti tra il 2013 e il 2018 (età media 64 anni, p = .01). In quell’analisi la percentuale osservata di donne incluse nei RCT era del 26.8%, ma con riduzione nel tempo, passando dal 27.8% (anni 2001-2006) al 24.9% (anni 2013-2018). Erano state espresse nel 2009 critiche alle Linee Guida (anche se non in modo specifico a quelle riguardanti le ACS) da Tricoci e coll.[2]Tricoci P, Allen JM, Kramer JM, Califf RM, Smith SC Jr. Scientific evidence underlying the ACC/AHA clinical practiceguidelines. JAMA. 2009 Feb 25;301(8):831-41. doi: 10.1001/jama.2009.205 che esaminarono 54 Linee Guida nordamericane (AHA/ACC) e notarono come la maggior parte delle raccomandazioni avessero un livello di evidenza medio o basso (B o C), mentre quelle con maggiore evidenza (A) rappresentassero solo il 19% delle raccomandazioni. Una delle problematiche non affrontate nel presente studio concerne i conflitti di interesse che riguardano molti “esperti” estensori delle Linee Guida: una analisi del 2013 riportò percentuali elevate di relazioni finanziarie con il mondo dell’industria[3]Norris SL, Holmer HK, Ogden LA, Burda BU, Fu R. PLoS One. Conflicts of interest among authors of clinical practice guidelines for glycemic control in type 2 diabetes mellitus. 2013 Oct … Continua a leggere anche in termini di “supporto per la ricerca” (con percentuali variabili di Autori con tali conflitti tra il 4% e il 78%) e addirittura di possesso di azioni (tra il 2% e il 17% degli Autori).
Editoriale: Le linee guida cliniche: imperfette ma irrinunciabili
Zoran Olivari, Ospedale San Camillo di Treviso
La finalità della ricerca medica è stabilire se il beneficio atteso di un determinato percorso diagnostico-terapeutico supera le eventuali conseguenze negative con un margine sufficientemente ampio, tale da ritenere che valga la pena di effettuarlo. L’insieme dei risultati delle ricerche cliniche dovrebbe consentirci di definire la cura giusta, per il paziente giusto, per la malattia giusta, al momento giusto dal provider giusto, sulla base delle risorse diagnostico-terapeutiche disponibili. Quindi il percorso più appropriato. Le Linee Guida cliniche (LG) si propongono di favorire l’appropriatezza diagnostico-terapeutica fornendo un periodico aggiornamento riassuntivo delle evidenze disponibili su tematiche cliniche specifiche. Queste evidenze formano la base delle raccomandazioni su cosa dovrebbe o non dovrebbe essere fatto (classi I e III) e identificano l’area di incertezza (classe II) nelle svariate patologie e popolazioni di pazienti. Poiché i trial clinici randomizzati (RCT) forniscono le evidenze di maggiore solidità scientifica, le raccomandazioni derivanti da almeno 2 RCT di elevata qualità, o le loro metanalisi, sono generalmente classificate come i livelli di evidenza (LE) A. I LE B (basati su un singolo RCT o studi osservazionali) e LE C (sostanzialmente basati sul consenso fra gli Autori delle LG) supportano con minore solidità scientifica le raccomandazioni espresse. Va da sé che alcune raccomandazioni rimarranno per sempre di LE C, in quanto mai saranno fatti trial per rispondere a certi quesiti come per esempio se fare un ECG o non farlo nella sindrome coronarica acuta, se visitare il paziente con scompenso vs non farlo, se discutere i casi complessi in team multidisciplinari vs non farlo, ecc. Il continuo evolvere di risorse diagnostico-terapeutiche, valutate negli studi clinici, impone periodiche revisioni delle LG ed è ovvio che le raccomandazioni possano cambiare nel tempo: fra le raccomandazioni di Classe I delle LG ACC/AHA, pubblicate nel periodo 1998-2007 e quelle nel periodo 2006-2013, veniva confermato “solo” il 90%, 81% e 74% di quelle che avevano inizialmente e rispettivamente i livelli di evidenza A, B e C e la maggior parte dei downgrade e omissioni riguardava le indicazioni non basate sui RCT[4]Neuman M, et al. Durability of Class I American College of Cardiology/American Heart Association Clinical Practice Guideline Recommendations. JAMA. 2014;311(20):2092-2100.. Purtroppo, soltanto una minoranza delle raccomandazioni sono supportate da LE A: nella globalità delle LG cardiologiche europee e americane pubblicate nel periodo 2003-2018 solo il 21% e il 12.9% rispettivamente, erano basate su LE A(2,3) salite al 38.2% nelle 5 LGC dell’ESC pubblicate nel 2019[5]Van Dijk BW, et al. Cardiovascular guidelines based on high-quality evidence: Are we getting there? European Journal of Preventive Cardiology 2019; 26(18) 1915–1917.. Di conseguenza esiste un limite “strutturale” intrinseco delle LG dovuto al fatto che solo una minoranza delle raccomandazioni si basa su evidenze derivanti da almeno due RCT sullo stesso quesito clinico. In merito ai RCT, pur fornendo essi le risposte più attendibili relativamente al beneficio o meno di un determinato trattamento, il lettore attento dovrebbe sempre ricordarsi che anche questi studi sono soggetti a limiti derivanti dal disegno e dalle metodologie dei trial, alcuni dei quali elencati a seguire. La robustezza del trial: il “fragility index” (FI) definisce il numero di eventi necessari per trasformare un risultato statisticamente significativo in non significativo. Più basso sarà questo valore, minore sarà la “solidità” del trial. In ben 35% dei RCT che supportavano le LG sullo scompenso cardiaco nel periodo 2010-2015, il FI era <10 e nel 20% il numero di pazienti persi al follow-up era superiore al FI[6]Docherty FK, et al. How robust are clinical trials in heart failure? European Heart Journal 2017; 38:338–345., mentre nel 27.5% dei RCT sulla rivascolarizzazione pubblicati nel periodo 2012-2018 il FI era <3 (!) e nel 42.5% il numero dei persi al follow-up era superiore al FI[7]Gaudino M, et al. Systematic Evaluation of the Robustness of the Evidence Supporting Current Guidelines on Myocardial Revascularization Using the Fragility Index. Circ Cardiovasc Qual Outcomes. … Continua a leggere. Quindi, anche i risultati dei RCT possono essere intrinsecamente “deboli” e potenzialmente contraddetti da un trial successivo. Il ruolo degli sponsor: la maggior parte dei RCT è sponsorizzato dalle aziende operanti nel campo farmacologico e dei dispositivi[8]Flacco ME, et al. Head-to-head randomized trials are mostly industry sponsored and almost always favor the industry sponsor. Journal of Clinical Epidemiology 2015; 68: 811e820. e il loro contributo al progresso delle conoscenze è indubbiamente determinante; tuttavia, lo scopo preminente di questi sponsor può essere quello di ottenere la registrazione di un dispositivo o di un farmaco e/o di ottenere un upgrade a livello delle raccomandazioni delle LG. Un’analisi della Cochrane Library conclude che, rispetto a studi con altre fonti di finanziamento, gli studi supportati dall’industria portano più frequentemente a conclusioni positive, ma con minore consequenzialità fra i risultati conseguiti e le conclusioni riportate[9]Lundh A, et al. Industry sponsorship and research outcome. Cochrane Database of Systematic Reviews 2017, Issue 2.. In particolare, i trial relativi alla cardiologia interventistica tendono ad essere numericamente piccoli, con follow-up brevi, con potenza statistica limitata e il supporto commerciale sembra indurre al maggior divario fra i risultati ottenuti e il loro reporting[10]Gaudino M, et al. Characteristics of Contemporary Randomized Clinical Trials and Their Association With the Trial Funding Source in Invasive Cardiovascular Interventions. JAMA Intern Med. … Continua a leggere. Inoltre, i trial con esito “negativo” spesso non vengono pubblicati, talora perché nemmeno sottoposti alle riviste di settore. Quando lo studio viene finanziato da enti o istituzioni “non profit” vi è maggiore probabilità che anche i trial con esito “negativo o neutro” vengano pubblicati e talora possono avere un impatto sulla pratica clinica uguale o maggiore dei trial “positivi”[11] Kitzman WD, et al. Rate-Adaptive Pacing for Heart FailureWith Preserved Ejection Fraction. JAMA 2023; 329(10): 797-99 e incidere sulle raccomandazioni delle LG. Modifiche del disegno dello studio in itinere: in circa un terzo dei RCT almeno uno degli end-point primari viene modificato nel corso dello studio e, in questi, l’effetto del trattamento risulta essere più favorevole rispetto ai trial che perseguono il disegno inziale[12]Chen T, et al. Comparison of Clinical Trial Changes in Primary Outcome and Reported Intervention Effect Size Between Trial Registration and Publication. JAMA Network Open. 2019;2(7):e197242. Rappresentatività dei RCT: in pressochè la totalità dei RCT i criteri di inclusione/esclusione portano al mancato arruolamento di donne, anziani e pazienti con comorbidità, con conseguente basso talora bassissimo rapporto fra i pazienti “screenati” e quelli arruolati; per esempio nel periodo 1991-2000 il 37% dei pazienti con infarto in USA aveva un età >75, ma nello stesso periodo solo il 9% degli arruolati nei RCT su quel tema aveva >75 anni[13]Lee PY, et al. Representation of elderly persons and women in published randomized trials of acute coronary syndromes. JAMA 2001;286:708–13.. Anche lo studio riportato su questo numero di Journal Map[14]Mas-Llado C, González-Del-Hoyo M, Siquier-Padilla J: Representativeness in randomised clinical trials supporting acute coronary syndrome guidelines. Eur Heart J Qual Care Clin Outcomes. 2023 Jan … Continua a leggere conclude che gli RCT alla base delle LG sulle sindromi coronariche acute, spesso non sono pienamente rappresentativi della popolazione affetta da tale patologia e dello standard of care aggiornato o addirittura nemmeno applicabili a questo scenario clinico. Il valore clinico del risultato di un RCT: il raggiungimento di un beneficio statisticamente significativo rappresenta l’obiettivo e la speranza della maggior parte dei ricercatori. Tuttavia, sta al lettore interpretare la valenza clinica del risultato ottenuto e non sempre un risultato statisticamente significativo equivale a un risultato clinicamente significativo, in particolare quando l’end-point primario dello studio combina, fra di loro, eventi di “peso” diversissimo (p.es. la mortalità e la riospedalizzazione). Quindi, la comprensione corretta della letteratura scientifica e di ogni singolo RCT richiede una capacità di valutazione e di interpretazione dei dati da parte del lettore, che non può limitarsi a una semplice lettura delle poche righe riassuntive nelle “conclusioni” degli studi scientifici. Poichè non tutti i medici hanno il tempo e le competenze necessarie per le analisi approfondite dell’esorbitante numero delle pubblicazioni, sono proprio gli Autori delle LG a tentare le loro sintesi aggiornate, auspicabilmente tenendo conto dei vari bias degli studi citati. L’expertise degli Autori delle LG è un punto di forza, ma anche di potenziale debolezza delle raccomandazioni finali, in quanto gli stessi Autori sono spesso coinvolti direttamente negli studi clinici e talora condizionati dai convincimenti personali su questioni spesso prive di certezze scientifiche. La consapevolezza diffusa riguardo ad elementi di “debolezza” delle LG ha indotto nel tempo una serie di raccomandazioni sulla metodologia della stesura delle stesse[15]Committee on Standards for Developing Trustworthy Clinical Practice Guidelines, Institute of Medicine. Clinical Practice Guidelines We Can Trust. Washington, DC: National Academies Press; 2011. proprio per fornire loro maggiore robustezza e applicando le quali molti dei bias descritti possono essere perlomeno in parte superati. Le LG non sono che lo specchio dei limiti della conoscenza medica in un dato momento storico e con i quali il clinico deve fare i conti tutte le volte che propone uno specifico percorso diagnostico-terapeutico per un determinato paziente. A volte può trovarsi di fronte al “paziente giusto”, analogo a quelli arruolati nei RCT che hanno dimostrato il beneficio di un certo approccio, e quindi applicare la “cura giusta”. Purtroppo, molto spesso, non si trova davanti al “paziente giusto”, in quanto portatore di caratteristiche che lo avrebbero escluso dall’essere arruolato in un RCT e quindi scegliere la “cura giusta” non può che basarsi sulla cultura, la preparazione specifica e l’esperienza del singolo medico e/o dell’equipe. Non è nemmeno lontanamente ipotizzabile che tutti gli scenari clinici potranno essere affrontati nei RCT specifici e per questo motivo è crescente il ruolo di studi osservazionali ben disegnati che possono trarre informazioni utili dalla realtà clinica e fornire suggerimenti diagnostico-terapeutici da integrare con quelli derivanti dai RCT. In questa direzione si sono mosse le Società Scientifiche ACC/AHA che attualmente autorizzano nelle loro LG il livello di evidenza A basato non solo sui RCT ma anche su studi osservazionali di elevata qualità[16]Hernandez AF, et al. What is needed now to improve cardiovascular clinical registries in the future? JAMA Cardiol. doi:10.1001/jamacardio.2018.4946.. In conclusione, nonostante i loro limiti, le Linee Guida Cliniche rappresentano uno sforzo lodevole delle Società Scientifiche per migliorare l’appropriatezza dei percorsi diagnostico-terapeutici e la loro applicazione ha impattato favorevolmente sulla prognosi di molti pazienti. Le raccomandazioni contenute sono quanto di più si avvicina alla gestione ottimale dei pazienti, ma alle quali non deve essere attribuita una valenza impositiva interpretandole invece esattamente per quello che sono: una guida dell’operare clinico quotidiano da seguire con maggiore aderenza possibile, ma anche da adattare di volta in volta a scenari clinici e pazienti specifici. Le innegabili criticità delle LG riflettono i vuoti conoscitivi in numerosi scenari clinici e popolazioni dei pazienti, ma sono il meglio disponibile per avvicinare la nostra pratica quotidiana ad un benchmark ottimale.
Bibliografia[+]
| ↑1 | Tahhan AS, Vaduganathan M, Greene SJ, et al. Enrollment of Older Patients, Women, and Racial/Ethnic Minority Groups in Contemporary Acute Coronary Syndrome Clinical Trials: A Systematic Review. JAMA Cardiol 2020; 5: 714–722 |
|---|---|
| ↑2 | Tricoci P, Allen JM, Kramer JM, Califf RM, Smith SC Jr. Scientific evidence underlying the ACC/AHA clinical practiceguidelines. JAMA. 2009 Feb 25;301(8):831-41. doi: 10.1001/jama.2009.205 |
| ↑3 | Norris SL, Holmer HK, Ogden LA, Burda BU, Fu R. PLoS One. Conflicts of interest among authors of clinical practice guidelines for glycemic control in type 2 diabetes mellitus. 2013 Oct 14;8(10):e75284. doi: 10.1371/journal.pone.0075284 |
| ↑4 | Neuman M, et al. Durability of Class I American College of Cardiology/American Heart Association Clinical Practice Guideline Recommendations. JAMA. 2014;311(20):2092-2100. |
| ↑5 | Van Dijk BW, et al. Cardiovascular guidelines based on high-quality evidence: Are we getting there? European Journal of Preventive Cardiology 2019; 26(18) 1915–1917. |
| ↑6 | Docherty FK, et al. How robust are clinical trials in heart failure? European Heart Journal 2017; 38:338–345. |
| ↑7 | Gaudino M, et al. Systematic Evaluation of the Robustness of the Evidence Supporting Current Guidelines on Myocardial Revascularization Using the Fragility Index. Circ Cardiovasc Qual Outcomes. 2019;12: 1-9. |
| ↑8 | Flacco ME, et al. Head-to-head randomized trials are mostly industry sponsored and almost always favor the industry sponsor. Journal of Clinical Epidemiology 2015; 68: 811e820. |
| ↑9 | Lundh A, et al. Industry sponsorship and research outcome. Cochrane Database of Systematic Reviews 2017, Issue 2. |
| ↑10 | Gaudino M, et al. Characteristics of Contemporary Randomized Clinical Trials and Their Association With the Trial Funding Source in Invasive Cardiovascular Interventions. JAMA Intern Med. 2020;180(7):993-1001. |
| ↑11 | Kitzman WD, et al. Rate-Adaptive Pacing for Heart FailureWith Preserved Ejection Fraction. JAMA 2023; 329(10): 797-99 |
| ↑12 | Chen T, et al. Comparison of Clinical Trial Changes in Primary Outcome and Reported Intervention Effect Size Between Trial Registration and Publication. JAMA Network Open. 2019;2(7):e197242 |
| ↑13 | Lee PY, et al. Representation of elderly persons and women in published randomized trials of acute coronary syndromes. JAMA 2001;286:708–13. |
| ↑14 | Mas-Llado C, González-Del-Hoyo M, Siquier-Padilla J: Representativeness in randomised clinical trials supporting acute coronary syndrome guidelines. Eur Heart J Qual Care Clin Outcomes. 2023 Jan 25:qcad007. doi: 10.1093/ehjqcco/qcad007. |
| ↑15 | Committee on Standards for Developing Trustworthy Clinical Practice Guidelines, Institute of Medicine. Clinical Practice Guidelines We Can Trust. Washington, DC: National Academies Press; 2011. |
| ↑16 | Hernandez AF, et al. What is needed now to improve cardiovascular clinical registries in the future? JAMA Cardiol. doi:10.1001/jamacardio.2018.4946. |
Accedi per leggere tutto l'articolo
Inserisci i dati del tuo account su Cardiotalk per accedere e leggere tutto il contenuto dell'articolo.
Se non hai un account, clicca sul pulsante registrati e verrai reindirizzato al portale Cardiotalk per la registrazione.

