Stefano De Servi, Università degli Studi di Pavia
Inquadramento
Gli studi di confronto tra eparina non frazionata (UFH) e bivalirudina (BIVA – un inibitore diretto della trombina con breve emivita), in pazienti STEMI sottoposti a PCI primaria sono stati condizionati da numerosi fattori che hanno contribuito all’esito dei trial. La sequenza degli studi di confronto ha mostrato come UFH debba essere utilizzata in monoterapia, mentre BIVA debba essere somministrata proseguendo l’infusione anche al termine della procedura di PCI. Infatti, l’associazione a UFH di inibitori della glicoproteina IIb/IIIa, e l’esecuzione della PCI attraverso la via femorale ha incrementato i bleeding favorendo, nel confronto, BIVA[1]Stone GW, Witzenbichler B, Guagliumi G, et al. Bivalirudin during primary PCI in acute myocardial infarction. N Engl J Med 2008; 358: 2218–30.. Peraltro, il mancato utilizzo dell’infusione di BIVA ad alta dose al termine della PCI si è associato a un aumento delle trombosi dello stent favorendo, nel confronto, UFH somministrata in monoterapia[2]Shahzad A, Kemp I, Mars C, et al. Unfractionated heparin versus bivalirudin in primary percutaneous coronary intervention (HEAT-PPCI): an open-label, single centre, randomised controlled trial. … Continua a leggere. Non sono stati eseguiti ampi studi randomizzati su efficacia e sicurezza di UFH (utilizzando prevalentemente la via radiale e senza utilizzo sistematico di inibitori GPIIb/ IIIa) versus BIVA intraprocedurale seguita da infusione ad alta dose in pazienti STEMI.
Lo studio in esame
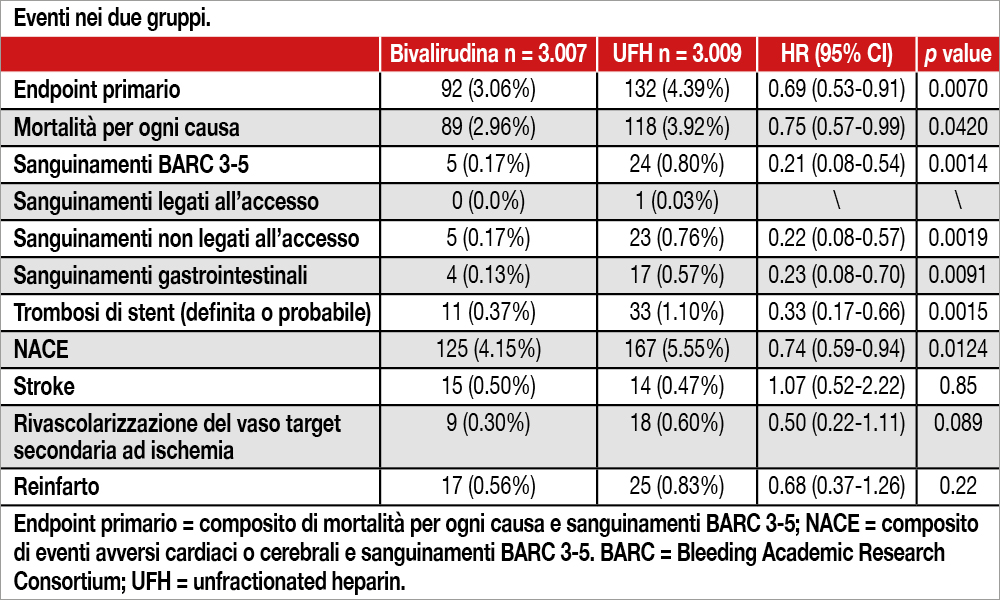
Lo studio BRIGHT-4 (Bivalirudin With Prolonged Full-Dose Infusion During Primary PCI Versus Heparin Trial), condotto in 87 centri cinesi, ha arruolato 6.016 pazienti STEMI con presentazione entro 48 ore (88% entro 12 ore), sottoposti a PCI primaria per via radiale, randomizzandoli a BIVA intraprocedurale seguita da infusione ad alta dose per 2/4 ore (n=3.009) versus UFH (n=3.007). I pazienti avevano un’età media di 60.5 anni, erano prevalentemente maschi (78.5 %), con classe Killip III-IV nel 10.5% dei casi e utilizzo della via radiale nel 93.1% dei casi. Il vaso più frequentemente trattato era l’arteria discendente anteriore (49%), mentre le procedure multivasali erano poco rappresentate (4.5%). Il tempo medio “contatto medico-guidina intracoronarica” è stato di 1.7 ore (1.1 ore nei pazienti non trasferiti da altro ospedale). L’activated clotting time (ACT) risultava più elevato nei pazienti BIVA (321 s [IQR 278–365]) che nei pazienti randomizzati a UFH (267 s [238–317]). Più elevato, inoltre, l’utilizzo di tirofiban nel gruppo UFH (BIVA 11,5%; UFH 13,7%, p= 0,012). A 30 giorni l’endpoint primario (mortalità per ogni causa e bleeding – BARC 3-5) è stato significativamente ridotto nel gruppo BIVA (hazard ratio [HR] 0,69, 95% CI 0,53–0,91; p= 0,0070). Sono state osservate significative riduzioni anche per la mortalità per ogni causa, bleeding BARC 3-5 e la trombosi di stent (vedi Tabella). I risultati sono stati coerenti in tutti i sottogruppi considerati tranne che per i pazienti con BMI ≥ 25 (p for interaction= 0,03) per quelli con classe Killip III-IV (p for interaction= 0,0002) e per i pazienti con score di bleeding CRUSADE elevato (p for interaction= 0,04).
Take home message
Nei pazienti STEMI, sottoposti a PCI primaria eseguita per via radiale, l’anticoagulazione intraprocedurale con BIVA, seguita da infusione ad alta dose post-PCI, ha ridotto in modo significativo rispetto a UFH in monoterapia, l’endpoint primario, un composito di morte per ogni causa e bleeding tipo BARC 3-5.
Interpretazione dei dati
I risultati di questo studio differiscono da quelli di MATRIX che aveva arruolato oltre 7.000 pazienti, con sindrome coronarica acuta (di cui il 55% STEMI) non mostrando differenze significative di outcome tra pazienti trattati con BIVA o UFH. Nello stesso studio i pazienti BIVA erano ulteriormente randomizzati ad avere o meno l’infusione post-PCI (non mostrandone peraltro alcun vantaggio)[3] Valgimigli M, Frigoli E, Leonardi S, et al. Bivalirudin or unfractionated heparin in acute coronary syndromes. N Engl J Med 2015; 373: 997–1009.. Anche lo studio VALIDATESWEDEHEART[4]Erlinge D, Omerovic E, Fröbert O, et al. Bivalirudin versus heparin monotherapy in myocardial infarction. N Engl J Med 2017;377: 1132–42. non ha mostrato differenze tra i due anticoagulanti in un ampio trial (oltre 6.000 pazienti) che ha incluso sia pazienti STEMI (50%) che NSTEMI, utilizzando infusione di BIVA anche post-PCI, ma non in tutti pazienti (65% dei casi). In quel trial, tuttavia, i pazienti randomizzati a BIVA potevano ricevere in attesa della PCI un bolo di eparina. BRIGHT-4 è, ad oggi, lo studio più ampio sin qui condotto in pazienti STEMI. Il bleeding maggiore (BARC 3-5) è stato inferiore a quanto osservato in MATRIX, verosimilmente per il dosaggio minore di eparina utilizzato in BRIGHT-4 (70 U/Kg versus 70-100 U/Kg in MATRIX). Da notare che l’endpoint in MATRIX era soprattutto dettato dagli infarti peri-procedurali (oltre 8% versus <1% in BRIGHT-4) più facilmente diagnosticabili in pazienti NSTEACS che in pazienti STEMI. Inoltre, BIVA riduceva nello studio MATRIX del 45% i bleeding maggiori e del 29% la mortalità globale (entrambi i dati statisticamente significativi). Interessante nello studio BRIGHT-4 è l’osservazione che nei pazienti in classe Killip III-IV non sono presenti gli effetti benefici di BIVA osservati nella popolazione generale. Una ipotesi è che BIVA venga degradata da peptidasi endogene, che potrebbero essere modificate nelle condizioni caratterizzate da bassa portata rendendo meno efficace il farmaco. L’analisi di sottogruppi, tuttavia, non è stata corretta per la presenza di altre variabili e potrebbe essere soggetta a errore.
Editoriale
Sono sufficienti i risultati del BRIGHT-4 a sancire il ritorno della bivalirudina nei pazienti affetti da STEMI e sottoposti ad angioplastica primaria?
Matteo Maurina, Damiano Regazzoli
Dipartimento di Scienze Biomediche, Humanitas University, Milano; Cardio Center, IRCCS Humanitas Research Hospital, Rozzano (MI)
Nei pazienti affetti da STEMI, un’adeguata inibizione piastrinica e una corretta anticoagulazione sono fondamentali per ridurre le complicanze trombotiche durante e dopo l’angioplastica primaria. Entrambe, tuttavia, aumentano il rischio di eventi emorragici. Per quanto riguarda i farmaci anticoagulanti, i più comuni sono l’eparina non frazionata e la bivalirudina. Mentre l’eparina è certamente più utilizzata nella pratica clinica, i dati relativi alla bivalirudina sono contrastanti. Alcuni studi suggeriscono la sua superiorità rispetto all’eparina in termini di riduzione di sanguinamenti e mortalità, mentre altri la associano a un aumento del rischio di trombosi di stent. Una possibile spiegazione a questi risultati, tuttavia, potrebbe risiedere nel protocollo di somministrazione della bivalirudina: è stato infatti ipotizzato che la trombosi di stent sia favorita dall’interruzione immediata dell’infusione del farmaco dopo angioplastica, mentre la sua continuazione per qualche ora dopo la procedura possa ridurre questa complicanza senza aumentare il rischio di sanguinamenti. Lo studio BRIGHT-4 è un trial randomizzato eseguito su 6.016 pazienti affetti da STEMI in 87 ospedali cinesi tra il 14 Febbraio 2019 e il 7 Aprile 2022. I pazienti inclusi sono stati randomizzati ad anticoagulazione con eparina non frazionata o bivalirudina. In particolare, il protocollo di somministrazione della bivalirudina prevedeva un bolo di 0.75 mg/kg prima della coronarografia, seguito da un’infusione di 1.75 mg/Kg/h durante la procedura e per 2-4 ore dopo la stessa, con ulteriori eventuali aggiustamenti in base alla misurazione dell’ACT. Per quanto riguarda l’eparina non frazionata, essa veniva somministrata mediante un bolo di 70 U/Kg prima della procedura, seguita da ulteriori boli intraprocedurali a seconda del’ACT. Il follow-up dello studio è stato eseguito a 1, 6 e 12 mesi. L’endpoint primario è un composito di mortalità per ogni causa e sanguinamenti maggiori (BARC 3-5). I pazienti inclusi erano maggiormente uomini (78.5%) e per lo più di età superiore ai 65 anni (59.2%). Per quanto riguarda le caratteristiche procedurali, si segnala un più elevato valore di ACT nel gruppo bivalirudina (tempo mediano= 321 s vs 267 s) e un maggior ricorso al tirofiban a seguito di complicanze trombotiche procedurali nei pazienti randomizzati a eparina (13.7% vs 11.5%, p=0.0122). L’approccio alla procedura è stato radiale nella grande maggioranza dei casi (93.1%). L’endpoint composito primario a 30 giorni si è verificato in minor percentuale nei pazienti randomizzati a bivalirudina, secondariamente a una minor incidenza di entrambi i suoi componenti. Quanto alle complicanze emorragiche, bisogna notare come la minor incidenza di sanguinamenti sia per lo più dovuta ad una riduzione di emorragie “non access-related”, principalmente gastrointestinali. Infine, l’uso della bivalirudina si è associato a un minor numero di trombosi di stent (0.37% vs 1.10%) e di NACE (composito di MACCE o sanguinamenti BARC 3-5) (4.15% vs 5.55%), come riportato in Tabella. Gli autori concludono che l’utilizzo pre, intra, e post-procedurale di bivalirudina nei pazienti affetti da STEMI si è rivelato superiore rispetto all’eparina non frazionata in termini di riduzione di mortalità per ogni causa e sanguinamenti a 30 giorni dopo l’evento indice. L’uso della bivalirudina, inoltre, sembra essere associato anche a una minore incidenza di trombosi di stent. Gli studi ad ora disponibili di confronto tra bivalirudina ed eparina non frazionata nel setting dello STEMI hanno dato risultati eterogenei. Nonostante trial di larga scala come HORIZONS-AMI[5]Stone, G. W. et al. Bivalirudin during Primary PCI in Acute Myocardial Infarction. New England Journal of Medicine 358, 2218–2230 (2008). ed EUROMAX[6]Steg, P. G. et al. Bivalirudin Started during Emergency Transport for Primary PCI. New England Journal of Medicine 369, 2207–2217 (2013). abbiano mostrato un beneficio della bivalirudina in termini di riduzione di sanguinamenti e mortalità, essa non è entrata stabilmente nella pratica clinica, principalmente a causa dell’associazione con un rilevato aumento di trombosi di stent. Va notato, tuttavia, che questi trial confrontavano la bivalirudina con l’eparina per lo più associata a inibitori della GpIIb/IIIa, ai quali è stato attribuito l’eccesso di sanguinamenti. Inoltre, la somministrazione di bivalirudina veniva interrotta subito al termine della procedura interventistica, il che potrebbe essere compatibile con un suo effetto rebound in termini pro-trombotici data la sua breve emivita (circa 25 minuti). Al di là di queste considerazioni, si è comunque preferito abbandonare l’uso degli inibitori della GpIIb/IIIa ed utilizzare la sola eparina in monoterapia, ritenendo che il progressivo switch da accesso femorale a radiale avrebbe ulteriormente ridotto le complicanze emorragiche. Successivi studi hanno alimentato la confusione in questo ambito: i trial MATRIX[7]Valgimigli, M. et al. Bivalirudin or Unfractionated Heparin in Acute Coronary Syndromes. New England Journal of Medicine373, 997–1009 (2015). e VALIDATESWEDEHEART[8]Erlinge, D. et al. Bivalirudin versus Heparin Monotherapy in Myocardial Infarction. New England Journal of Medicine 377,1132–1142 (2017). non hanno mostrato differenze in termini di mortalità tra i due farmaci, con risultati eterogenei riguardo i sanguinamenti. Anche in questi studi, tuttavia, era consentita la co-somministrazione di eparina nel gruppo bivalirudina e l’uso degli inibitori della GpIIb/IIIa nei pazienti randomizzati a eparina. Inoltre, i protocolli di somministrazione della bivalirudina erano vari (alto o basso dosaggio e con o senza infusione continua dopo l’angioplastica). Date queste premesse, i risultati del BRIGHT-4 vanno interpretati alla luce del metodo rigoroso con cui lo studio è stato condotto. In primis, l’infusione di bivalirudina veniva proseguita in media per 3 ore anche dopo la procedura interventistica. Inoltre, i pazienti venivano trattati con bivalirudina o eparina senza aggiunta di inibitori di GpIIb/IIIa, i quali venivano eventualmente somministrati solo in caso di complicanze trombotiche procedurali. È verosimile che il largo ricorso all’accesso radiale sia il principale motivo della pressochè assenza di sanguinamenti relativi all’accesso, mentre è possibile che il beneficio della bivalirudina sulla riduzione di emorragie “non-access related” sia da ricercare nelle sue proprietà farmacodinamiche e cinetiche e nella assenza di correlazione con la trombocitopenia indotta da farmaco (tipica invece dell’eparina). Come sottolineato dagli autori, lo studio è caratterizzato da alcune limitazioni, prima tra tutte la sua natura “open label”. Inoltre, l’inclusione di soli pazienti cinesi limita l’applicabilità dei risultati all’intera popolazione mondiale. Lo studio in esame rappresenta certamente un tentativo di passo in avanti verso un’ulteriore riduzione degli eventi avversi nel setting dell’infarto miocardico acuto. Inoltre, la sua modalità di esecuzione rigorosa permette di trarre nuove conclusioni in merito al tema, fino ad ora irrisolto, dell’uso degli anticoagulanti prima, durante e dopo il trattamento percutaneo dello STEMI. Anzitutto, bisogna riconoscere che rispetto ai precedenti studi di confronto tra eparina e bivalirudina nel setting dello STEMI, il BRIGHT-4 ha un disegno nettamente più moderno, il che rende i suoi risultati più generalizzabili ai tempi attuali. Oltre al sopracitato rigoroso e ben preciso protocollo di somministrazione della bivalirudina, infatti, lo studio rispecchia in gran parte la comune pratica clinica: l’approccio radiale è stato utilizzato in più del 90% dei casi e la maggioranza dei pazienti (70%) è stata trattata con ticagrelor in aggiunta ad ASA. I risultati sembrano segnare una netta vittoria della bivalirudina sull’eparina nel setting dello STEMI trattato con angioplastica primaria: non solo essa si associa a una riduzione dell’outcome composito primario del 1.3%, ma il suo utilizzo genera una significativa riduzione di un endpoint “forte” come la mortalità per ogni causa. Di fronte a questi dati, dunque, la domanda che sorge spontanea è la seguente: “sono sufficienti questi risultati a sancire il ritorno della bivalirudina nei pazienti affetti da STEMI e sottoposti ad angioplastica primaria?”. Per rispondere a questa domanda, occorre tenere presente vari elementi. Anzitutto, vi è un tema relativo alla gestione dei farmaci: la somministrazione di eparina non frazionata in bolo è certamente più immediata e facile rispetto all’infusione continua di bivalirudina, specialmente quando quest’ultima viene poi continuata anche nelle prima ore postprocedurali. In secondo luogo, vi è una questione economica, avendo la bivalirudina un costo maggiore dell’eparina. Per quanto concerne questo aspetto, tuttavia, la questione appare di poco conto di fronte alla possibilità di ridurre mortalità e complicanze emorragiche nei pazienti affetti da infarto miocardico. Inoltre, è opportuno domandarsi se a un’ipotetica analisi costo-beneficio, la riduzione degli eventi avversi con la bivalirudina non causi secondariamente anche un vantaggio in termini economici. Da ultimo, occorre tenere a mente che i risultati a 30 giorni, per quanto già incoraggianti, necessitano di ulteriore conferma a un follow-up maggiore. Come già sopracitato, infine, l’inclusione di pazienti unicamente cinesi rende, al momento, i risultati dello studio difficilmente applicabili all’intera popolazione mondiale. A seguito di queste considerazioni, è opportuno concludere dicendo che sebbene i risultati del BRIGHT-4 siano certamente interessanti, appare quantomeno improbabile che questo studio sia in grado di cambiare la pratica clinica attuale con effetto immediato. Tuttavia, questi dati pongono le basi per ulteriori studi clinici randomizzati che prevedano l’uso di una dose completa e standardizzata di bivalirudina prima, durante e dopo l’angioplastica primaria, al fine di determinare se essa debba stabilmente diventare l’anticoagulante di prima scelta nei pazienti affetti da STEMI e trattati con angioplastica primaria in tutto il mondo.
Bibliografia[+]
| ↑1 | Stone GW, Witzenbichler B, Guagliumi G, et al. Bivalirudin during primary PCI in acute myocardial infarction. N Engl J Med 2008; 358: 2218–30. |
|---|---|
| ↑2 | Shahzad A, Kemp I, Mars C, et al. Unfractionated heparin versus bivalirudin in primary percutaneous coronary intervention (HEAT-PPCI): an open-label, single centre, randomised controlled trial. Lancet 2014; 384: 1849–58. |
| ↑3 | Valgimigli M, Frigoli E, Leonardi S, et al. Bivalirudin or unfractionated heparin in acute coronary syndromes. N Engl J Med 2015; 373: 997–1009. |
| ↑4 | Erlinge D, Omerovic E, Fröbert O, et al. Bivalirudin versus heparin monotherapy in myocardial infarction. N Engl J Med 2017;377: 1132–42. |
| ↑5 | Stone, G. W. et al. Bivalirudin during Primary PCI in Acute Myocardial Infarction. New England Journal of Medicine 358, 2218–2230 (2008). |
| ↑6 | Steg, P. G. et al. Bivalirudin Started during Emergency Transport for Primary PCI. New England Journal of Medicine 369, 2207–2217 (2013). |
| ↑7 | Valgimigli, M. et al. Bivalirudin or Unfractionated Heparin in Acute Coronary Syndromes. New England Journal of Medicine373, 997–1009 (2015). |
| ↑8 | Erlinge, D. et al. Bivalirudin versus Heparin Monotherapy in Myocardial Infarction. New England Journal of Medicine 377,1132–1142 (2017). |
Accedi per leggere tutto l'articolo
Inserisci i dati del tuo account su Cardiotalk per accedere e leggere tutto il contenuto dell'articolo.
Se non hai un account, clicca sul pulsante registrati e verrai reindirizzato al portale Cardiotalk per la registrazione.

