Introduzione
Benché sia acquisito che la riperfusione permetta di ridurre l’area infartuale con modalità tempo-dipendente, è altresì noto che in taluni casi essa possa paradossalmente associarsi al fenomeno della “reperfusion injury” che causa un ulteriore danno miocardico, responsabile di un aumento dell’area infartuale (“infarct surge”)[1] Yellon DM, Hausenloy DJ. Myocardial reperfusion injury. N Engl J Med. 2007;357:1121–1135.. L’ostruzione microvascolare (MVO), che può persistere anche dopo una riperfusione apparentemente efficace, può complicarsi con la distruzione del microcircolo con conseguente emorragia intramiocardica (IMH), causa di ulteriore danno microvascolare, estensione dell’area ipossica per effetto compressivo o per tossicità diretta. Non ci sono studi, tuttavia, che abbiano illustrato la concatenazione degli eventi che portano al fenomeno dell’infarct surge e all’espansione dell’area necrotica.
Lo studio in esame
Lo studio si compone di una parte clinica, condotta in 70 pazienti STEMI e di una parte sperimentale (17 modelli canini disponibili per l’analisi). Nella prima, la cinetica del rilascio di troponina (ottenuta con prelievi seriati) dopo PCI risultava differente nei pazienti in cui la risonanza magnetica (MRI, eseguita a 6-8 giorni dall’evento acuto e ripetuta a 6-8 mesi) mostrava la presenza di IMH. La presenza di IMH determinava un picco più elevato entro le prime 12 ore, mentre nei pazienti senza IMH avveniva entro 24 ore.
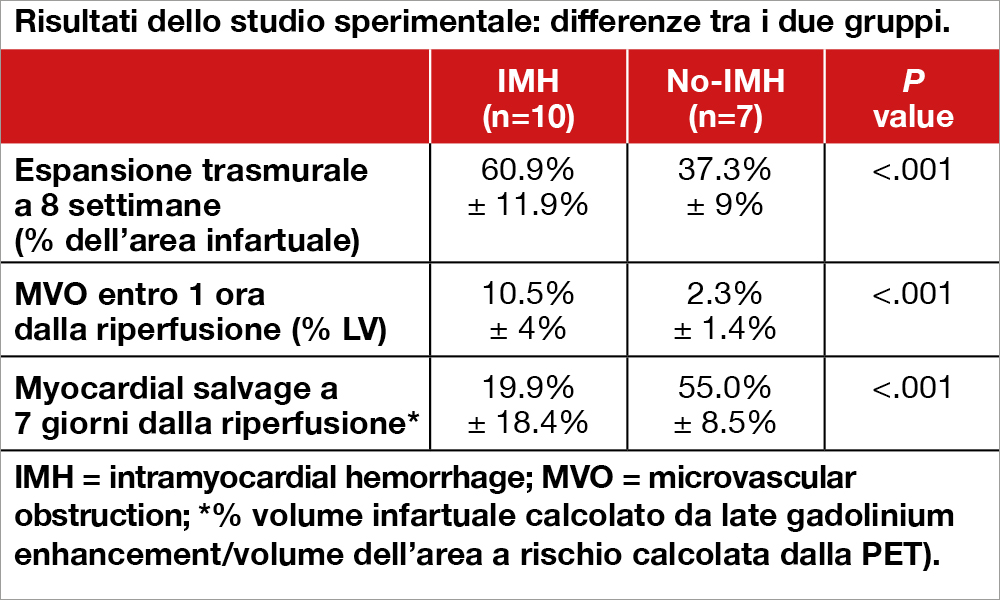
Nella parte sperimentale dello studio, negli animali (con arteria discendente anteriore legata e poi riperfusa a 3 ore) che presentavano IMH alla MRI (eseguita ogni 24-48 ore sino al settimo giorno e ripetuta a 8 settimane) la riperfusione induceva un’espansione dell’area necrotica coinvolgente l’epicardio, fenomeno non evidente quando IMH non era presente (P<0.001). L’infarct size era simile nei due gruppi di animali a 1 ora dalla riperfusione, ma risultava più ampio a 72 ore se IMH era presente (P<0.01). Il “myocardial salvage” a 7 giorni dalla riperfusione (calcolato come % del volume infartuale misurato utilizzando il “late gadolinium enhancement” rispetto al volume dell’area a rischio calcolata dalla PET eseguita con ammonio 13) risultava significativamente maggiore se IMH non era presente, vedi Tabella.
Take home message
L’emorragia miocardica è una determinante fondamentale dell’ampiezza finale dell’area infartuale. Essa assume quindi un ruolo clinico rilevante e dovrà essere oggetto di interventi atti a ridurne l’incidenza e le conseguenze negative.
Interpretazione dei dati
Discutendo i dati dello studio, gli Autori commentano come il “fronte d’onda” dell’emorragia intramiocardica provochi un vero e proprio tsunami, annullando il beneficio prodotto dalla riperfusione iniziale: infatti se la MVO senza IMH porta a una espansione della area infartuale iniziale di circa il 20% nei giorni successivi alla riperfusione, la presenza di IMH comporta una espansione dell’80%. Quindi nell’era moderna della rivascolarizzazione, l’entità della necrosi finale dipende non solo dalla ampiezza della area a rischio e dal tempo di ischemia, ma anche dal danno iatrogeno della riperfusione. Benché la presenza di IMH possa dipendere dalla durata dell’ischemia, i dati sperimentali di questo studio (in tutti i modelli canini il tempo di ischemia era simile) mostrano come altri fattori, tuttora non noti, possono determinare questa temibile complicanza. Compito della ricerca futura sarà quello di identificarli per poter instaurare terapie efficaci.
L’opinione di Gianluca Campo e Antonella Scala
UO Cardiologia, Azienda Ospedaliero Universitaria di Ferrara
Negli ultimi venti anni la prognosi del paziente con infarto miocardico è notevolmente cambiata grazie ai progressi nell’ambito dell’angioplastica primaria. L’istituzione territoriale di reti ben strutturate per la gestione e lo smistamento dei pazienti con infarto miocardico acuto verso centri con emodinamica 24/7, ha permesso di ridurre significativamente i tempi symptom’s onset to-balloon e door-to balloon. L’ottimizzazione della terapia medica di fase acuta (in particolare della terapia antitrombotica) ha ulteriormente contributo alla riduzione dell’estensione finale dell’infarct size e della mortalità ospedaliera per infarto[2]Ibanez B, James S, Agewall S, et al. 2017 ESC Guidelines for the management of acute myocardial infarction in patients presenting with ST-segment elevation. Eur Heart J. 2018;39:119-177.. Tuttavia, la pratica clinica quotidiana ci rammenta spesso che non tutti i pazienti rispondono alla terapia riperfusiva allo stesso modo. Non tutti i pazienti, sebbene precocemente riperfusi, tornano a casa con una frazione d’eiezione conservata. Ancora una quota non trascurabile di pazienti, nonostante i nostri sforzi in sala di emodinamica e in UTIC, viene dimesso con una estesa necrosi e va incontro a rimodellamento cardiaco con plurimi accessi per scompenso cardiaco. Fino al 50% dell’estensione finale dell’infarct size di questi pazienti, è riconducibile ai complessi fenomeni molecolari e cellulari che riconduciamo al cosiddetto “danno da ischemia-riperfusione”[3]Heusch G, Gersh BJ. The pathophysiology of acute myocardial infarction and strategies of protection beyond reperfusion: a continual challenge. Eur Heart J. 2017;38:774-784.. In termini banali, una quota di cardiomiociti che erano ancora vivi al momento della riperfusione (sebbene ischemici) vengono uccisi da una serie di fenomeni molecolari che la stessa riperfusione innesca. Questo non significa che si sarebbero “salvati” senza riperfusione, ma solo che abbiamo, purtroppo, perso una parte del beneficio che potevamo apportare al paziente. I fenomeni riconducibili al danno da ischemia-riperfusione sono molteplici spaziando dalle aritmie indotte dalla riperfusione, al miocardio “stordito” (myocardial stunning), al danno da riperfusione letale (mitocondrio-mediato) e all’ostruzione microvascolare[4]Davidson SM, Ferdinandy P, Andreadou I, et al. Multitarget Strategies to Reduce Myocardial Ischemia/Reperfusion Injury: JACC Review Topic of the Week. J Am Coll Cardiol. 2019;73:89-99..
Il microcircolo coronarico gioca in questo contesto un ruolo fondamentale, rappresentando il reale effettore del destino del miocardio soggetto a insulto da ischemia-riperfusione: al momento del ripristino del flusso coronarico il microcircolo sarà bersaglio dei detriti derivanti dalla placca, degli aggregati cellulari, con una conseguente possibile disgregazione del letto vascolare e sviluppo di emorragia intramiocardica[5]Ibáñez B, Heusch G, Ovize M, Van de Werf F. Evolving therapies for myocardial ischemia/reperfusion injury. J Am Coll Cardiol. 2015;65:1454-71..
Ting Liu et al., in questo studio, hanno valutato il ruolo dell’emorragia intramiocardica nel determinare l’estensione finale dell’area infartuata dopo riperfusione coronarica. In modo rigoroso è stata eseguita una fase di studio osservazionale su pazienti con infarto ST sopra (STEMI) sottoposti a rivascolarizzazione coronarica, valutazione della cinetica della troponina e valutazione della presenza di emorragia intramiocardica mediante risonanza magnetica cardiaca (MRI). A questa prima fase è seguita una seconda fase su modello animale canino per confermare le osservazioni ottenute mediante l’impiego di imaging avanzato PET/ MRI e della cinetica della troponina. Lo studio conferma chiaramente come l’estensione finale dell’infarto sia anche determinata dalla presenza di emorragia intramiocardica. Tale fenomeno si sviluppa entro le 24 ore dalla riperfusione con un fronte d’onda che si propaga dall’endocardio all’epicardio. La presenza di emorragia intramiocardica si correla alla presenza di ostruzione microvascolare e determina la quota di “miocardio salvabile”, che si riduce di quasi 3 volte a 7 giorni dalla riperfusione in chi presenta tale fenomeno. Inoltre, nel modello canino e nei pazienti STEMI si verifica un brusco incremento di troponina a 12 ore dalla angioplastica solo in presenza di emorragia intramiocardica. L’entità in valore assoluto del picco di troponina tende a essere più alto e precoce in chi presenta emorragia intramiocardica. Ciò esita in una estensione dell’area infartuata valutata alla MRI significativamente maggiore in chi presenta emorragia intramiocardica, raggiungendo un picco di estensione seguito da un plateau nel modello canino a 72 ore dalla riperfusione. Questo studio dimostra che i determinanti finali dell’infarct size sono senza dubbio i noti e ben identificati tempo di ischemia ed estensione del miocardio a valle del vaso occluso, ma anche da un terzo elemento fino a oggi poco considerato che è l’emorragia intramiocardica. Quali meccanismi determinino l’evoluzione a emorragia intramiocardica di un infarto rivascolarizzato sono ancora sconosciuti. L’identificazione di questi meccanismi potrebbe essere di fondamentale importanza per la messa a punto di nuovi farmaci atti a ridurre il danno da ischemia-riperfusione nella sua componente dell’emorragia intramiocardica. È oramai da anni in fase di valutazione il ruolo del mitocondrio e del “mitochondrial permeability transition pore” nel danno da ischemia-riperfusione. La riperfusione di cellule ischemiche può in alcuni casi indurre, tramite gli ioni calcio e la generazione di radicali liberi dell’ossigeno, la formazione di un canale aspecifico ubicato sulla membrana mitocondriale (canale chiamato appunto mitochondrial permeability transition pore). Tale canale genera movimenti anomali e afinalistici delle sostanze e come conseguenza la struttura mitocondriale si altera in maniera irreversibile. Il risultato finale è la morte della cellula. Questo fenomeno è la quota di danno da riperfusione letale (mitocondrio-mediato) che, interagendo con il danno microvascolare, dovrebbe portare all’epifenomeno emorragia intramiocardica – estensione infarct size[6]Morciano G, Giorgi C, Bonora M, et al. Molecular identity of the mitochondrial permeability transition pore and its role in ischemia-reperfusion injury. J Mol Cell Cardiol. 2015;78:142-53..
Alla luce degli importanti risultati di Liu et al. rimane a questo punto da verificare questa relazione tra l’alterata attività mitocondriale e la presenza ed estensione dell’emorragia intramiocardica. Infatti, si potrebbe verificare se l’impiego di composti target che rallentino o impediscano la cascata di eventi che portano al danno mitocondriale, siano in realtà anche in grado di ridurre l’estensione del fronte d’onda dell’emorragia intramiocardica e quindi dell’infarct size. Inoltre, considerato l’impatto prognostico a breve e a lungo termine dell’estensione della cicatrice fibrotica (principale determinante di rimodellamento ventricolare e ospedalizzazione per scompenso cardiaco) [7]Stone GW, Selker HP, Thiele H, et al. Relationship Between Infarct Size and Outcomes Following Primary PCI: Patient-Level Analysis From 10 Randomized Trials. J Am Coll Cardiol. 2016;67:1674-83., la rapida individuazione di un cluster di pazienti a elevato rischio di evoluzione infartuale emorragica permetterebbe l’adozione di strategie terapeutiche aggiuntive e un monitoraggio clinico più attento. Si potrebbe infatti speculare sulla stratificazione del rischio dei pazienti infartuati non solo con la stima dell’area infartuata alla MRI, come in questo studio, ma anche con indici prettamente indicativi della funzionalità microvascolare, come l’indice di resistenza microvascolare angiografico e l’indice di riserva perfusione miocardica misurabile tramite specifiche acquisizioni in MRI[8]Zhou W, Lee JCY, Leung ST, et al. Long-Term Prognosis of Patients With Coronary Microvascular Disease Using Stress Perfusion Cardiac Magnetic Resonance. JACC Cardiovasc Imaging. 2021;14:602-611.. In conclusione, i risultati dello studio di Liu et al. rappresentano un altro tassello dell’intricato puzzle relativo ai determinanti dell’estensione finale dell’infarto, fornendo nuovi target per studi relativi al danno da ischemia-riperfusione con l’obiettivo finale di identificare molecole/ strategie atte a ridurne il suo impatto sulla estensione finale dell’infarto.
Bibliografia[+]
| ↑1 | Yellon DM, Hausenloy DJ. Myocardial reperfusion injury. N Engl J Med. 2007;357:1121–1135. |
|---|---|
| ↑2 | Ibanez B, James S, Agewall S, et al. 2017 ESC Guidelines for the management of acute myocardial infarction in patients presenting with ST-segment elevation. Eur Heart J. 2018;39:119-177. |
| ↑3 | Heusch G, Gersh BJ. The pathophysiology of acute myocardial infarction and strategies of protection beyond reperfusion: a continual challenge. Eur Heart J. 2017;38:774-784. |
| ↑4 | Davidson SM, Ferdinandy P, Andreadou I, et al. Multitarget Strategies to Reduce Myocardial Ischemia/Reperfusion Injury: JACC Review Topic of the Week. J Am Coll Cardiol. 2019;73:89-99. |
| ↑5 | Ibáñez B, Heusch G, Ovize M, Van de Werf F. Evolving therapies for myocardial ischemia/reperfusion injury. J Am Coll Cardiol. 2015;65:1454-71. |
| ↑6 | Morciano G, Giorgi C, Bonora M, et al. Molecular identity of the mitochondrial permeability transition pore and its role in ischemia-reperfusion injury. J Mol Cell Cardiol. 2015;78:142-53. |
| ↑7 | Stone GW, Selker HP, Thiele H, et al. Relationship Between Infarct Size and Outcomes Following Primary PCI: Patient-Level Analysis From 10 Randomized Trials. J Am Coll Cardiol. 2016;67:1674-83. |
| ↑8 | Zhou W, Lee JCY, Leung ST, et al. Long-Term Prognosis of Patients With Coronary Microvascular Disease Using Stress Perfusion Cardiac Magnetic Resonance. JACC Cardiovasc Imaging. 2021;14:602-611. |
Accedi per leggere tutto l'articolo
Inserisci i dati del tuo account su Cardiotalk per accedere e leggere tutto il contenuto dell'articolo.
Se non hai un account, clicca sul pulsante registrati e verrai reindirizzato al portale Cardiotalk per la registrazione.

