L’identificazione dei fattori di rischio causali e dei trattamenti efficaci per prevenire le patologie cardiovascolari è fondamentale per la salute pubblica e dei singoli individui. Benché i trial randomizzati siano indubbiamente il gold standard per stabilire un nesso di causa-effetto tra un fenomeno e i suoi potenziali fattori patogenetici, tuttavia questi trial sono lunghi e costosi. Gli studi di associazione su larga scala dell’intero genoma (large-scale genome-wide association studies -GWAS-) ci hanno permesso nell’ultima decade di associare numerose varianti genetiche a specifici fattori di rischio cardiovascolare, come l’indice di massa corporea, la pressione arteriosa, i disturbi del metabolismo glicemico, le dislipidemie e il consumo di tabacco. Queste scoperte sono basate su studi di randomizzazione mendeliana (MR), che utilizza una variazione genetica come esperimento naturale per stabilire rapporti di causa-effetto, partendo da studi osservazionali. La MR è una applicazione dell’analisi delle variabili strumentali che ha lo scopo di testare una ipotesi causale basandosi su dati non-sperimentali. In una randomizzazione mendeliana le varianti genetiche (generalmente un polimorfismo di un singolo nucleotide) sono utilizzate come variabili strumentali per individuare un presunto fattore di rischio.
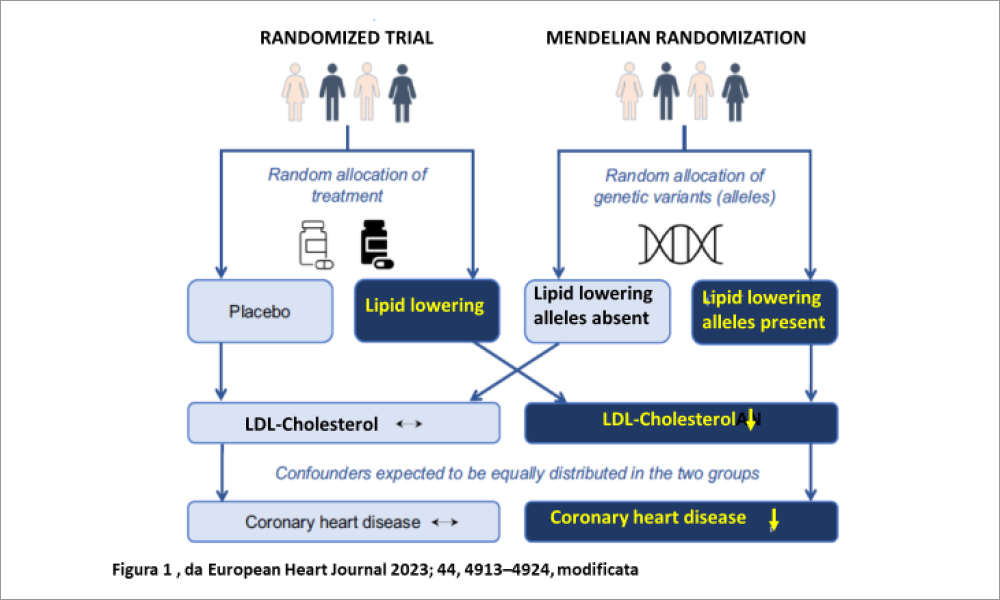
Il principio alla base della MR è la seconda legge di Mendel che riguarda la segregazione degli alleli quando il DNA viene trasmesso dai genitori alla progenie al momento della formazione dei gameti. Questo fenomeno avviene in modo random, così come l’assegnazione di un trattamento in uno studio randomizzato (Figura 1), in modo tale da formare gruppi con caratteristiche simili, riducendo il rischio di una differente distribuzione dei fattori confondenti (come invece avviene in uno studio osservazionale). Rispetto agli studi randomizzati, quelli basati su MR sono più veloci e meno costosi, in quanto utilizzano dati GWAS pre-esistenti. Va detto che spesso le varianti genetiche hanno un effetto modesto sulla maggior parte dei fattori di rischio (spiegano cioè una piccola parte della variazione, talora meno del 5% dei fenotipi complessi) . In tali casi, quando sono disponibili multiple varianti genetiche, esse possono essere combinate in uno “score poligenico“ che è la somma “pesata” dei genotipi dipendenti dalle varianti. Questo score può essere utilizzato come variabile strumentale nelle successive analisi.
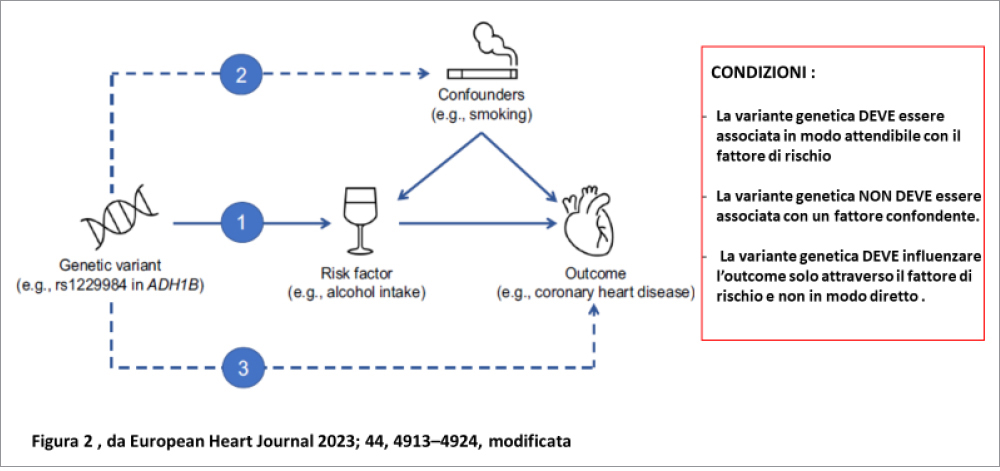
I prerequisiti, che devono essere osservati affinché i risultati ottenuti dagli studi di MR siano validi sono mostrati nella Figura 2. Essi sono:
1) la variante genetica deve essere associata in modo attendibile con il fattore di rischio che si vuole studiare;
2) la variante genetica non deve essere associata con un fattore confondente per la patologia cui il fattore di rischio è correlato;
3) la variante genetica deve influenzare l’outcome solo attraverso il fattore di rischio e non in modo diretto.
Gli studi di MR possono essere a un unico campione (“one-sample MR”) quando le associazioni tra variante genetica e fattore di rischio da un lato e variante genetica e outcome dall’altro sono indagate in una unica popolazione, mentre nella randomizzazione a due campioni (two-sample MR) le associazioni sono studiate in due popolazioni differenti. Questi studi di MR sono stati utilizzati non solo per indagare potenziali associazioni causali tra fattori di rischio e sviluppo di una patologia cardiovascolare, ma anche per predire l’efficacia di un farmaco. Infatti, molti farmaci agiscono su target proteici, che sono codificati da geni specifici. Possono così essere usate varianti nella regione del gene codificante per prevedere l’effetto farmacologico e anche gli eventuali danni collaterali.
Accedi per leggere tutto l'articolo
Inserisci i dati del tuo account su Cardiotalk per accedere e leggere tutto il contenuto dell'articolo.
Se non hai un account, clicca sul pulsante registrati e verrai reindirizzato al portale Cardiotalk per la registrazione.

