Inquadramento
La nefropatia acuta da contrasto (AKI) è una nota e temuta complicanza delle procedure di PCI. Al suo verificarsi contribuiscono la presenza di comorbilità, in particolare una malattia cronica renale preesistente e il diabete, la complessità delle procedure, la quantità di mezzo di contrasto iniettato. Per ridurre e mitigare l’incidenza di questo fenomeno, che ha un peso prognostico non trascurabile, gli operatori impiegano una serie di accorgimenti quali l’utilizzo di mezzi di contrasto a bassa osmolarità, l’espansione del volume[1]Briguori C, D’Amore C, De Micco F, et al. Left ventricular end-diastolic pressure versus urine flow rate-guided hydration in preventing contrast-associated acute kidney injury. JACC Cardiovasc … Continua a leggere, la sospensione cautelativa di alcuni farmaci. Per predire l’insorgenza di AKI sono stati proposti numerosi score di rischio, alcuni tuttavia un po’ datati[2]Mehran R, Aymong ED, Nikolsky E, et al. A simple risk score for prediction of contrast-induced nephropathy after percutaneous coronary intervention: development and initial validation. J Am Coll … Continua a leggere, altri complessi e di non facile utilizzo.
Lo studio in esame
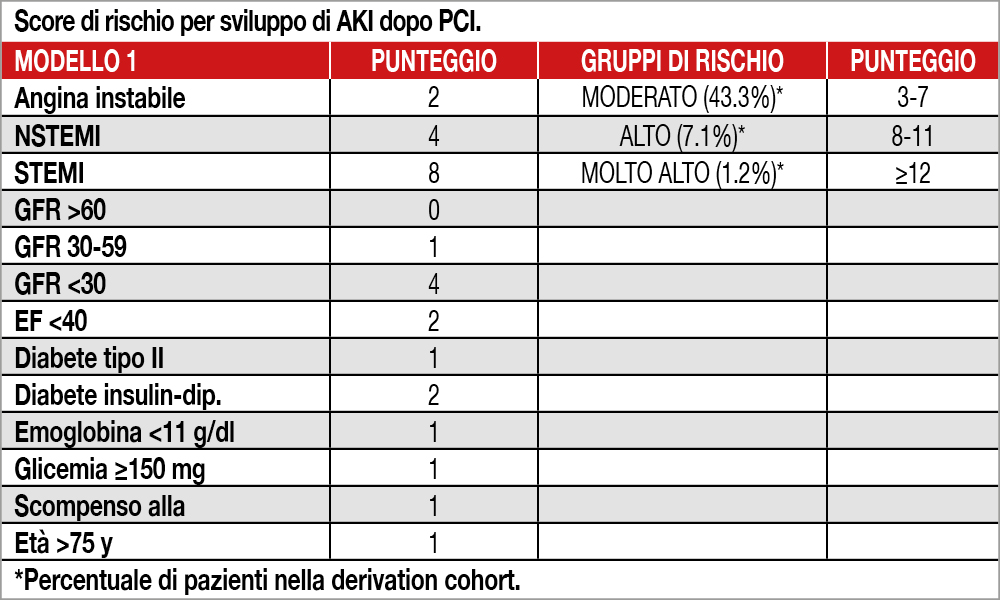
Gli Autori hanno incluso globalmente 20.222 pazienti (14.616 nella “derivation cohort” e 5.606 nella “validation cohort”). AKI (aumento della creatinina di almeno il 50% del valore basale oppure almeno 0.3 mg/dL entro 48 ore dalla PCI) è stata diagnosticata in 860 pazienti (4.3%). Predittori indipendenti, basati solo sulle variabili disponibili prima della procedura (modello 1), sono risultate: presentazione clinica (tipo di ACS/ cardiopatia ischemica stabile), eGFR, FE, diabete, emoglobina, scompenso, glicemia basale, età. Le variabili procedurali (modello 2) sono risultate: volume di contrasto, bleeding periproceduarle, PCI ad anatomia complessa, presenza di slow-flow/no-flow. Per ogni modello è stato costruito uno score di rischio stratificato in gruppi a crescente rischio di AKI (Tabella). L’inclusione delle variabili procedurali del modello 2 aumentavano solo di poco il potere discriminante dello score di rischio (“derivation cohort”: c-statistics del modello 1:0.72, modello 2:0.74; “validation cohort” modello 1:0.84, modello 2:0.86). La mortalità a 1 anno aumentava in presenza di AKI (10·2% vs 2·5%; adjusted hazard ratio 1·76, 95% CI 1,31–2·36), soprattutto per una aumentata mortalità a 1 mese (adjusted HR 3·20, 95% CI 2·07–4·94).
Take home message
Uno score semplice, basato su variabili disponibili prima della PCI permette di calcolare con accuratezza il rischio di AKI, fortemente associato a più elevata mortalità.
Interpretazione dei dati
Il primo autore dello studio (Roxana Mehran) aveva proposto nel 2004(2) uno score che tuttavia non includeva i pazienti STEMI e aveva un basso potere discriminante (c-statistics 0.67). Lo score attuale non solo include i pazienti STEMI, ma fornisce dati ottenuti da procedure di PCI più complesse di quelle eseguite circa 20 anni fa, utilizzando inoltre dispositivi con tecnologia più avanzata rispetto a quelli allora in uso[3]Mehran R, Aymong ED, Nikolsky E, et al. A simple risk score for prediction of contrast-induced nephropathy after percutaneous coronary intervention: development and initial validation. J Am Coll … Continua a leggere.
Nella discussione si sottolinea l’importanza di riconoscere i pazienti a rischio di AKI prima della procedura di PCI per poter mettere in atto le misure preventive, soprattutto l’idratazione basata sul valore della pressione telediastolica del ventricolo sinistro, oppure correlata alla diuresi[4]Briguori C, D’Amore C, De Micco F, et al. Left ventricular end-diastolic pressure versus urine flow rate-guided hydration in preventing contrast-associated acute kidney injury. JACC Cardiovasc … Continua a leggere.
I risultati mostrano una correlazione significativa tra AKI e mortalità, un dato piuttosto dibattuto in letteratura, in quanto lo sviluppo di AKI potrebbe essere semplicemente un marker di una popolazione a rischio cardiovascolare elevato per la presenza di numerose comorbilità che hanno un peso prognostico negativo.
L’opinione di Carlo Briguori
Cardiologia Interventistica, Clinica Mediterranea, Napoli
Il punteggio di rischio proposto da Mehran et coll. rappresenta una versione aggiornata di quello proposto in precedenza[5]Mehran R, Aymong ED, Nikolsky E, et al. A simple risk score for prediction of contrast-induced nephropathy after percutaneous coronary intervention: development and initial validation. J Am Coll … Continua a leggere. Questo punteggio rappresenta uno strumento molto utile e semplice per predire nella pratica clinica il rischio di danno renale acuto, associato alla somministrazione di contrasto iodato durante procedure interventistiche cardiovascolari. Possiamo, infatti dividere i nostri pazienti in 4 gruppi di rischio con la consapevolezza che:
- circa il 92% dei pazienti avrà un rischio basso o moderato (rischio atteso 1-5%) e
- circa l’8% dei pazienti avrà un rischio alto o molto alto (rischio atteso 15-40%). Questa consapevolezza dovrebbe spingere il cardiologo clinico, il cardiologo interventista e il nefrologo a pianificare strategie di prevenzione calibrare al rischio predetto.
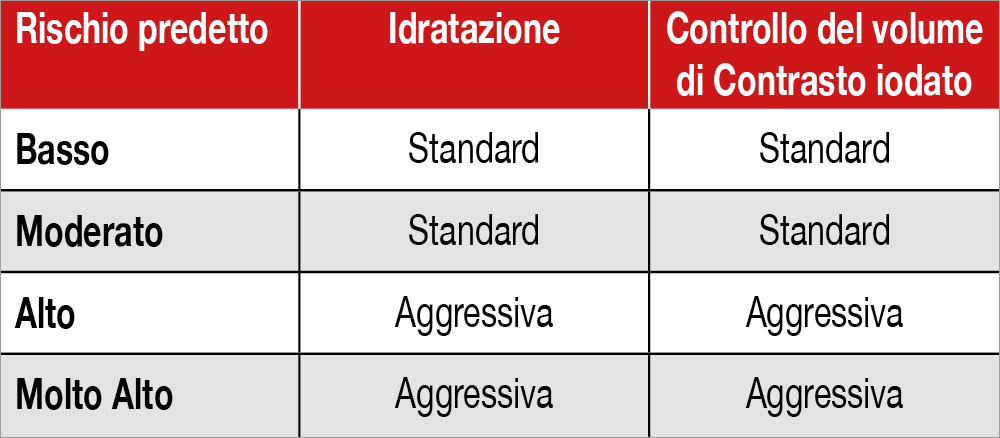
Le armi principali per prevenire il danno renale acuto associato alla somministrazione di mezzo di contrasto iodato sono:
- limitare il volume di contrasto iodato
- praticare una idratazione efficace.
Le attuali raccomandazioni suggeriscono:
- l’infusione di 1 mL/kg/h di soluzione fisiologica (0.5 mL/kg/h in caso di frazione di eiezione ≤35% o NYHA >2) 12 ore prima/24 dopo la somministrazione di contrasto iodato
- limitare il volume di contrasto iodato a massimo 2-3 volte il valore della filtrazione glomerulare basale [6]Neumann FJ, Sousa-Uva M, Ahlsson A, et al. 2018 ESC/EACTS Guidelines on myocardial revascularization. Eur Heart J 2018;40:87-165.. Definiamo queste strategie “standard”.
Nei pazienti a rischio alto o molto alto, tali strategie “standard” non sembrano essere altrettanto efficaci. Studi recenti suggeriscono un approccio più aggressivo in questi pazienti, quali:
- una idratazione controllata in base alla pressione telediastolica del ventricolo sinistro, oppure al flusso urinario con il sistema RenalGuard[7]Briguori C, D’Amore C, De Micco F, et al. Left ventricular end-diastolic pressure versus urine flow rate-guided hydration in preventing contrast-associated acute kidney injury. JACC Cardiovasc … Continua a leggere
- l’utilizzo di dispositivi che premettono una significativa riduzione del contrasto realmente somministrato al paziente, quale il sistema DyeVert[8]Briguori C, Golino M, Porchetta N et al. Impact of a contrast media volume control device on acute kidney injury rate in patients with acute coronary syndrome. Catheter Cardiovasc Interv. 2021 Jul … Continua a leggere.
Possiamo definire queste strategie “aggressive”. Nella tabella propongo un algoritmo di applicazione nella pratica clinica del punteggio di rischio proposto da Mehran e coll.
Bibliografia[+]
| ↑1 | Briguori C, D’Amore C, De Micco F, et al. Left ventricular end-diastolic pressure versus urine flow rate-guided hydration in preventing contrast-associated acute kidney injury. JACC Cardiovasc Interv 2020; 13: 2065–74 |
|---|---|
| ↑2, ↑3, ↑5 | Mehran R, Aymong ED, Nikolsky E, et al. A simple risk score for prediction of contrast-induced nephropathy after percutaneous coronary intervention: development and initial validation. J Am Coll Cardiol 2004; 44: 1393–99Mehran R, Aymong EA, Nikolsky E, et al. A simple risk score for prediction of contrastinduced nephropathy after percutaneous coronary intervention: development and initial validation. J Am Coll Cardiol 2004 Oct 6;44(7):1393-9. |
| ↑4, ↑7 | Briguori C, D’Amore C, De Micco F, et al. Left ventricular end-diastolic pressure versus urine flow rate-guided hydration in preventing contrast-associated acute kidney injury. JACC Cardiovasc Interv 2020; 13: 2065–74. |
| ↑6 | Neumann FJ, Sousa-Uva M, Ahlsson A, et al. 2018 ESC/EACTS Guidelines on myocardial revascularization. Eur Heart J 2018;40:87-165. |
| ↑8 | Briguori C, Golino M, Porchetta N et al. Impact of a contrast media volume control device on acute kidney injury rate in patients with acute coronary syndrome. Catheter Cardiovasc Interv. 2021 Jul 1;98(1):76-84. |
Accedi per leggere tutto l'articolo
Inserisci i dati del tuo account su Cardiotalk per accedere e leggere tutto il contenuto dell'articolo.
Se non hai un account, clicca sul pulsante registrati e verrai reindirizzato al portale Cardiotalk per la registrazione.

