Stefano De Servi, Università degli Studi di Pavia
Inquadramento
Le linee guida correnti raccomandano l’utilizzo dell’imaging coronarico per ottimizzare l’impianto di stent nei pazienti sottoposti a PCI complessa (classe IIA)[1] Neumann FJ, Sousa-Uva M, Ahlsson A, et al. ESC Scientific Document Group. 2018 ESC/EACTS guidelines on myocardial revascularization. Eur Heart J. 2019;40(2):87–165., sulla scia di studi che ne hanno dimostrato la superiorità nell’ottenere una più ampia area luminale rispetto alla semplice guida angiografica[2]Zhang J, Gao X, Kan J, et al. Intravascular ultrasound versus angiography-guided drug-eluting stent implantation: the ULTIMATE trial. J Am Coll Cardiol. 2018;72(24):3126–3137.; Lee JM, Choi KH, … Continua a leggere. Lo studio OCTIVUS[3]Kang DY, Ahn JM, Yun SC, et al. OCTIVUS Investigators.Optical. Coherence Tomography-Guided or Intravascular Ultrasound-Guided Percutaneous Coronary Intervention: The OCTIVUS Randomized Clinical … Continua a leggere ha randomizzato una popolazione consecutiva di pazienti trattati con PCI a guida con eco intravascolare (IVUS) o a “optical coherence tomography” (OCT) non dimostrando differenze di outcome tra i pazienti in cui le procedure avevano guida IVUS o OCT (vedi Journal Map n 72). Tuttavia, è importante confrontare i due sistemi di guida nelle procedure complesse, quelle cioè che possono comportare un maggior rischio per il paziente.
Lo studio in esame
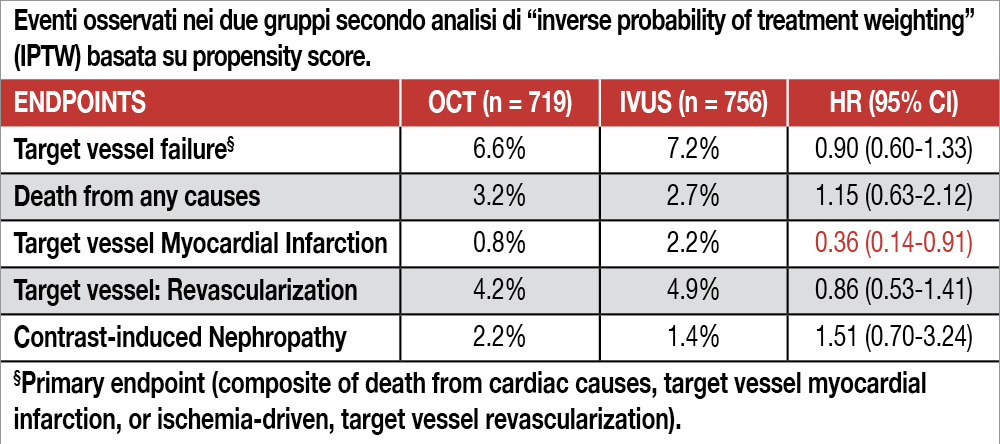
Analisi di sottogruppo pre-specificata dello studio OCTIVUS (Optical Coherence Tomography Versus Intravascular Ultrasound Guided Percutaneous Coronary Intervention) trial[4]Kang DY, Ahn JM, Yun SC, et al. OCTIVUS Investigators.Optical. Coherence Tomography-Guided or Intravascular Ultrasound-Guided Percutaneous Coronary Intervention: The OCTIVUS Randomized Clinical … Continua a leggere, volta a verificare eventuali differenze di outcome clinico o esito procedurale tra le due tecniche di imaging in pazienti sottoposti a PCI complessa (malattia del tronco comune non protetto, biforcazioni, lesioni ostiali, occlusioni totali, lesioni severamente calcifiche, ristenosi intra-stent, lesioni lunghe e diffuse, PCI multivasale). Venivano esclusi i pazienti STEMI, quelli con nefropatia avanzata, scompenso cardiaco o instabilità emodinamica. L’endpoint primario era un composito di morte cardiaca, infarto miocardico correlato al vaso target, rivascolarizzazione del vaso target. Su un totale di 2.008 pazienti randomizzati, oltre il 70% rientrava nella definizione di PCI complessa (n=1.475), di cui 719 (48.7%) ricevevano una PCI OCT-guidata e 756 (51.3%) una PCI IVUS-guidata. Vi erano differenze angiografiche tra i due gruppi: più frequente la malattia del tronco comune non protetto (20.2% versus 15.4%, P=0.02) e più elevato il Syntax score (valore mediano 17.0 versus 15.0, P=0.032) nei pazienti del gruppo IVUS-guidato rispetto al gruppo OCT-guidato. Per questo motivo l’outcome dei pazienti nei due gruppi è stato confrontato anche con la tecnica dell’“inverse probability of treatment weighting” basato sull’analisi del propensity score, stimato attraverso un modello multivariato di regressione logistica. A una mediana di follow-up di 2.0 anni, l’endpoint primario si verificava nel 6.5% dei pazienti OCT-guidati e nel 7.4% dei pazienti IVUS-guidati (HR: 0.87; 95% CI: 0.59-1.29; P=0.50). Le complicanze procedurali (dissezioni almeno di tipo B, perforazione, vasospasmo, trombosi, slow flow o no reflow, embolizzazione distale, occlusione acuta, tamponamento cardiaco, shock cardiogeno) risultavano più frequenti nel gruppo IVUS-guidato (3.4% vs 1.7%, P=0.03), mentre l’incidenza di nefropatia da contrasto risultava simile nei due gruppi (1.5% vs 1.9%; P=0.46). I dati in dettaglio sono mostrati nella Tabella.
Take home message
Nei pazienti sottoposti a PCI complessa, l’outcome a un follow-up di due anni è risultato simile tra coloro in cui la procedura è stata eseguita con guida OCT e quelli in cui la guida era rappresentata dall’IVUS.
Interpretazione dei dati
I risultati di questa analisi riproducono sostanzialmente quelli dello studio globale, già discussi nel Journal Map (n. 72). Del resto i pazienti inseriti in questo studio sono circa i tre quarti dell’intera casistica e, ovviamente, non ci si poteva attendere un esito differente. Al di là della “non-inferiorità” della guida OCT rispetto alla guida IVUS, ci sono due aspetti che colpiscono il lettore: il primo riguarda il numero di complicanze procedurali significativamente maggiore utilizzando IVUS che OCT, il secondo concerne l’incidenza di infarto miocardico significativamente più frequente sempre tra i pazienti IVUS. Entrambe queste differenze sarebbero da attribuire a un maggior numero di infarti periprocedurali presenti in quel gruppo. La causa risiederebbe nel fatto che la scelta del diametro dello stent è dettata, utilizzando l’eco intravascolare, dal diametro della membrana elastica esterna, mentre, con la guida OCT che ha una minore penetrazione, la scelta dello stent è effettuata in base alle dimensioni del diametro luminale. Perciò, la procedura guidata da IVUS è più aggressiva e quindi gravata da un maggior rischio di complicanze. D’altro canto l’area finale dello stent è risultata minore nei pazienti randomizzati alla guida OCT (minimum stent area 5.38 ± 1.90 per OCT versus 6.52 ± 2.28 per IVUS, P=0.001) con tutti i criteri di ottimizzazione dello stent raggiunti, secondo il documento di consenso dell’European Association of Percutaneous Coronary Interventions(5), nel 37.6% delle procedure OCT-guidate versus 46.0% di quelle IVUS-guidate (P=0.001). Nonostante ciò, gli eventi a due anni di follow-up non sono stati differenti nei due gruppi, in particolare non si è osservato un aumento delle rivascolarizzazioni del target vessel nel gruppo di PCI guidate dall’OCT. Questa è un’osservazione non trascurabile, che potrebbe indurre a rivedere i criteri, forse eccessivamente ambiziosi, che gli “esperti” hanno fissato quali obbiettivi da raggiungere per l’ottimizzazione del risultato procedurale[5]Raber L, Mintz GS, Koskinas KC, et al. Clinical use of intracoronary imaging. Part 1: Guidance and optimization of coronary interventions. An expert consensus document of the european association of … Continua a leggere. Guardando i vari sottogruppi di lesioni complesse, colpiscono alcune ampie differenze di outcome tra le due strategie di guida procedurale confrontate: ad esempio, nelle ristenosi intra-stent (n=168) gli eventi sono stati di gran lunga maggiori con l’utilizzo della guida IVUS (29.5% versus 10.5%, HR 0.36, 95% CI 0.17-0.78), mentre per i pazienti multivasali (n=105) con valori elevati di SYNTAX score (>32), gli eventi sono stati più frequenti tra i pazienti con procedure a guida OCT (22%) che con IVUS (11%, HR 3.19, 95%CI 1.02-10.04). Pur potendo trattarsi di semplici casualità, dovute all’analisi di molteplici sottogruppi, scopo della ricerca futura in questo ambito sarà quello di individuare quale sistema di imaging coronarico fornisca la migliore guida procedurale per le varie tipologie di lesioni complesse trattate con PCI.
Bibliografia[+]
| ↑1 | Neumann FJ, Sousa-Uva M, Ahlsson A, et al. ESC Scientific Document Group. 2018 ESC/EACTS guidelines on myocardial revascularization. Eur Heart J. 2019;40(2):87–165. |
|---|---|
| ↑2 | Zhang J, Gao X, Kan J, et al. Intravascular ultrasound versus angiography-guided drug-eluting stent implantation: the ULTIMATE trial. J Am Coll Cardiol. 2018;72(24):3126–3137.; Lee JM, Choi KH, Song YB, et al. RENOVATECOMPLEX-PCI Investigators. Intravascularimaging-guided or angiographyguided complex PCI. N Engl J Med. 2023;388(18):1668–1679. |
| ↑3, ↑4 | Kang DY, Ahn JM, Yun SC, et al. OCTIVUS Investigators.Optical. Coherence Tomography-Guided or Intravascular Ultrasound-Guided Percutaneous Coronary Intervention: The OCTIVUS Randomized Clinical Trial. Circulation. 2023 Oct 17;148:1195-1206. doi:10.1161/CIRCULATIONAHA.123.066429 |
| ↑5 | Raber L, Mintz GS, Koskinas KC, et al. Clinical use of intracoronary imaging. Part 1: Guidance and optimization of coronary interventions. An expert consensus document of the european association of percutaneous cardiovascular interventions. Eur Heart J. 2018;39:3281-3300. doi:10.1093/eurheartj/ehy285. |
Accedi per leggere tutto l'articolo
Inserisci i dati del tuo account su Cardiotalk per accedere e leggere tutto il contenuto dell'articolo.
Se non hai un account, clicca sul pulsante registrati e verrai reindirizzato al portale Cardiotalk per la registrazione.

