Stefano De Servi, Università degli Studi di Pavia
Inquadramento
Lo shock cardiogeno è una conseguenza molto temibile dell’infarto STEMI: si verifica in circa l’8% dei pazienti e ha tuttora una mortalità di circa il 50%[1] De Luca L, Olivari Z, Farina A, et al. Temporal trends in the epidemiology, management, and outcome of patients with cardiogenic shock complicating acute coronary syndromes.Eur J Heart … Continua a leggere. Gli studi sinora effettuati, suglieffetti dell’assistenza circolatoria meccanica, hanno dato risultati clinici deludenti. Infatti, sia la contropulsazione aortica che l’ECMO non si sono mostrati efficaci nel migliorare l’outcome di questi pazienti[2]Thiele H, Zeymer U, Thelemann N, et al. IABP-SHOCK II Investigators. Intraaortic Balloon Pump in Cardiogenic Shock Complicating Acute Myocardial Infarction: Long-Term 6-Year Outcome of the … Continua a leggere. Impella è una pompa a flusso microassiale (PFM) che drena sangue dal ventricolo sinistro e lo immette in aorta ascendente; in questo modo provoca un benefico “unloading” del ventricolo sinistro e aumenta la portata cardiaca. I piccoli studi iniziali non hanno dato risultati confortanti, ma non era mai stato eseguito un trial ampio di confronto tra PFM e terapia standard in pazienti STEMI in shock cardiogeno.
Lo studio in esame
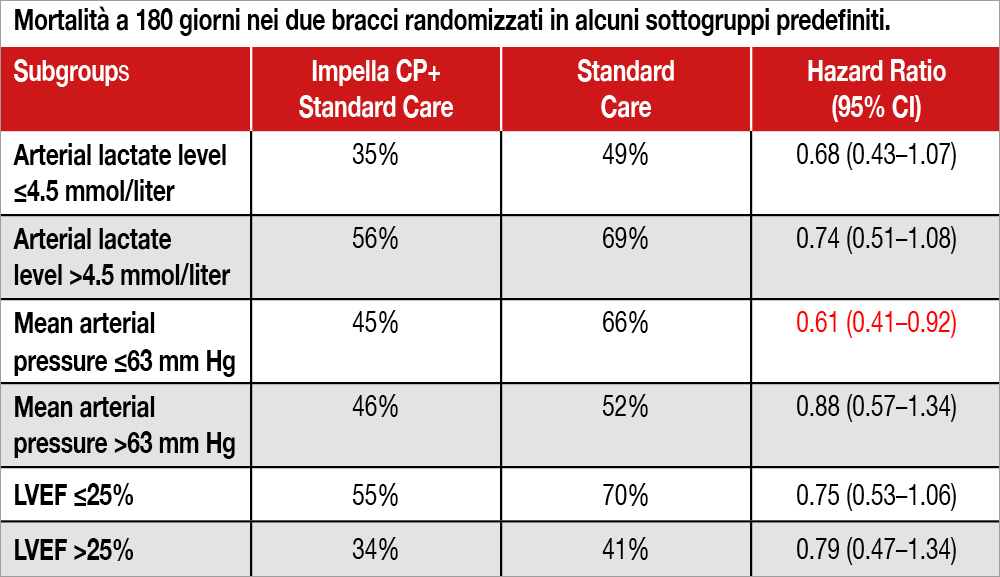
Nello studio internazionale DanGer Shock (eseguito in 4 centri danesi, 9 tedeschi e uno inglese) 355 pazienti STEMI in shock cardiogeno (mediana età 67 anni, sede anteriore 72%, arresto cardiaco resuscitato 21%, intubati prima della randomizzazione 19%, mediana lattati 4.5 mmol/L, 55% in stage “C” della classificazione SCAI, mediana pressione sistolica 82 mmHg, FE 25%) sono stati randomizzati all’inserimento di PFM (Impella CP, n=179) o alla “standard care” (n=176). Sono stati esclusi i pazienti in coma (Glasgow score <8) e con segni di scompenso destro. L’endpoint primario (morte per ogni causa a 180 giorni) si è verificato nel 45.8% del gruppo PFM e nel 58.5% del gruppo standard care (hazard ratio, 0.74; 95% confidence intervals [CI], 0.55 to 0.99; P=0.04). L’analisi di gruppi predefiniti è mostrata nella Tabella. L’endpoint secondario (“escalation” della terapia a un trattamento con ulteriore supporto meccanico, trapianto cardiaco, morte per ogni causa), è stato osservato nel 52.5% dei pazienti PFM e nel 63.6% del gruppo “standard care” (hazard ratio, 0.72; 95% CI, 0.55 to 0.95). Le complicanze sono risultate superiori (24.0%) nel gruppo PFM rispetto alla “standard care” (6.2%, HR 4.74; 95% CI, 2.36 to 9.55). In particolare, bleeding moderato o severo 21.8% versus 11.9%; ischemia dell’arto 5.6% versus 1.1%; terapia sostitutiva renale 41.9% versus 26.7%, sepsi con culture positive 5.1% versus 2.8%.
Take home message
L’uso routinario di PFM in pazienti STEMI in shock cardiogeno ha ridotto a 180 giorni la mortalità rispetto alla “standard care”, pur in presenza di un maggior numero di complicanze correlate in modo diretto o indiretto all’inserimento del dispositivo.
Interpretazione dei dati
Lo studio è sicuramente di grande rilievo clinico, in quanto è il primo che mostri l’efficacia di una tecnica di supporto circolatorio meccanico in pazienti STEMI in shock cardiogeno, per un endpoint quale la mortalità per ogni causa a 6 mesi dall’evento acuto (notevole il valore dell’NNT=8). Questo risultato è anche secondario a una attenta scelta dei criteri di inclusione ed esclusione: non sono stati infatti considerati arruolabili quei pazienti STEMI con arresto cardiaco che giungessero all’osservazione in coma (cioè con uno score <8 della Glasgow Coma scale); in tal modo si è ottenuta una casistica più omogenea, nella quale la causa di morte era la grave disfunzione ventricolare sinistra e non il risultato di lesioni cerebrali irreversibili correlate all’arresto cardiaco. Tuttavia, va osservato che oltre la metà dei pazienti in shock cardiogeno, potenzialmente eleggibili, sono stati esclusi dallo studio per questo motivo. L’inclusione di pazienti sottoposti a manovre rianimatorie e giunti in coma all’osservazione potrebbe essere la causa del fallimento di alcune modalità di supporto circolatorio meccanico in studi precedenti di pazienti STEMI in shock: nello studio ECLS-SHOCK[3]Thiele H, Zeymer U, Akin I, et al. ECLS-SHOCK Investigators. Extracorporeal Life Support in Infarct-Related Cardiogenic Shock. N Engl J Med. 2023;389:1286-1297. doi:10.1056/NEJMoa2307227, che aveva testato l’efficacia dell’ECMO, il 77% dei pazienti era stato rianimato prima della randomizzazione, contro il 20% circa dei pazienti arruolati nello studio presente. Peraltro, nell’analisi di sottogruppi effettuata nell’ECLS-SHOCK trial, nessun beneficio sembrava derivare dall’ECMO nei pazienti non sottoposti a rianimazione cardiopolmonare inclusi in quel trial. Inoltre, gli Autori di quel trial difesero la scelta di includere anche i pazienti sottoposti a rianimazione in quanto la loro esclusione avrebbe reso meno generalizzabili i risultati dello studio. Non è invece stata effettuata nell’IABP-SHOCK II trial, un’analisi per sottogruppi che includesse i pazienti rianimati per arresto cardiocircolatorio benchè il 45% dei pazienti inclusi in quello studio avesse avuto una rianimazione per arresto cardiaco, e oltre il 70% avesse “uno stato mentale alterato”[4] Thiele H, Zeymer U, Thelemann N, et al. IABP-SHOCK II Investigators. Intraaortic Balloon Pump in Cardiogenic Shock Complicating Acute Myocardial Infarction: Long-Term 6-Year Outcome of the … Continua a leggere. I risultati del Danger Shock trial potrebbero aprire una nuova era nel trattamento dei pazienti in shock cardiogeno, ma potrebbero anche far riconsiderare il ricorso ad altri sistemi di assistenza circolatoria sulla base di criteri di utilizzo più stringenti.
Editoriale: “Il DANGER SHOCK trial può aprire una nuova era… ma un passo per volta”
A cura di: Alessandro Fasolino, Enrico Baldi
- S.C. Cardiologia 1, Fondazione IRCCS Policlinico San Matteo, Pavia; Cardiac Arrest and Resuscitation Research Team (RESTART)
Lo shock cardiogeno, associato all’infarto miocardico acuto (AMI-CS), è una sindrome clinica caratterizzata da ipotensione rapidamente progressiva, ridotta portata cardiaca, aumento delle pressioni di riempimento sinistre e del postcarico sistemico che conducono a insufficienza circolatoria, ipoperfusione tissutale, disfunzione multiorgano e morte[5]Marbach JA, Di Santo P, Kapur NK, et al. Lactate Clearance as a Surrogate for Mortality in Cardiogenic Shock: Insights From the DOREMI Trial. J Am Heart Assoc [Internet] 2022;11(6). Available … Continua a leggere. Nonostante questa complicanza sia ben riconoscibile e riguardi l’8-10% dei pazienti STEMI[6]Jentzer JC, van Diepen S, Barsness GW, et al. Cardiogenic Shock Classification to Predict Mortality in the Cardiac Intensive Care Unit. J Am Coll Cardiol [Internet] 2019;74(17):2117–28. … Continua a leggere, la mortalità rimane alta (40-50%) e il suo trattamento variabile nei protocolli ospedalieri, in conseguenza di una scarsità di interventi basati sull’evidenza. Da un punto di vista farmacologico, manca un consenso sul farmaco inotropo da utilizzare[7]Mathew R, Di Santo P, Jung RG, et al. Milrinone as Compared with Dobutamine in the Treatment of Cardiogenic Shock. N Engl J Med 2021;385(6):516–25. non essendo stata dimostrata la superiorità di una terapia vasoattiva rispetto a un’altra[8]Parlow S, Santo P Di, Sterling LH, et al. Inotrope versus placebo therapy in cardiogenic shock: Rationale and study design of the CAPITAL DOREMI2 trial. Am Heart J [Internet] 2023;262:83–9. … Continua a leggere. Nonostante un razionale fisiopatologico favorevole e un’ampia diffusione dei sistemi di supporto circolatorio meccanico (MCS), la contropulsazione aortica[9]Thiele H, Zeymer U, Neumann F-J, et al. Intraaortic Balloon Support for Myocardial Infarction with Cardiogenic Shock. N Engl J Med [Internet] 2012;367(14):1287–96. Available from: … Continua a leggere e la “veno-arterial extracorporeal membrane oxygenation” -VA-ECMO[10]Thiele H, Zeymer U, Akin I, et al. Extracorporeal Life Support in Infarct-Related Cardiogenic Shock. N Engl J Med [Internet] 2023;389(14):1286–97. Available from: … Continua a leggere non hanno ridotto la mortalità in questa popolazione, peraltro con evidenza variabile di beneficio in differenti fenotipi di pazienti[11]Visconti LO, Camporotondo R, Ferlini M, Savastano S, Annoni G, Fasolino A. Il supporto della circolazione extracorporea nelle emergenze cardiologiche: evidenze scientifiche e pratica clinica. G Ital … Continua a leggere. L’unico intervento che ha costantemente diminuito la mortalità nell’AMI-CS è stata la precoce rivascolarizzazione del vaso colpevole[12]Hochman JS, Sleeper LA, Webb JG, et al. Early Revascularization in Acute Myocardial Infarction Complicated by Cardiogenic Shock. N Engl J Med [Internet] 1999;341(9):625–34. Available … Continua a leggere sia attraverso una PCI primaria o il bypass aortocoronarico. Per questi motivi la presentazione (e simultanea pubblicazione) dell’atteso DanGer Shock trial (Microaxial Flow Pump – mAFP – or Standard Care in Infarct-Related Cardiogenic Shock) ha suscitato entusiasmo nella comunità cardiologica[13]Møller JE, Engstrøm T, Jensen LO, et al. Microaxial Flow Pump or Standard Care in Infarct-Related Cardiogenic Shock. N Engl J Med [Internet] 2024;390(15):1382–93. Available from: … Continua a leggere: dopo oltre 20 anni, uno studio ha dimostrato che un nuovo intervento ha migliorato la sopravvivenza nella popolazione AMI-CS. Nello studio, 355 pazienti affetti da AMI-CS sono stati randomizzati 1:1 all’impianto percutaneo per 48 ore di mAFP al livello maggiore di performance nei confronti della standard care, utilizzando protocolli pre-specificati di escalation (in particolare, l’impianto sia di VA-ECMO o di mAFP chirurgico poteva essere considerato nel gruppo mAFP, mentre nel gruppo standard care l’escalation prevedeva l’uso di VA-ECMO e il ricorso a mAFP chirurgico era consentito). I pazienti inclusi nello studio costituivano una popolazione sufficientemente compromessa di AMI-CS: la mediana del lattato era 4.5 mmol/L, quella della frazione di eiezione 25%, il 20% dei pazienti era stato sottoposto a rianimazione cardiocircolatoria prima della randomizzazione (tuttavia un arresto cardiaco extraospedaliero prolungato con un Glasgow coma score <8, dopo il ripristino di una circolazione normale, rappresentava un criterio di esclusione). È stata effettuata una PCI immediata nel 96% dei casi. La randomizzazione precedeva la rivascolarizzazione nel 57% dei casi, il tempo mediano tra sintomi e randomizzazione era di 4.3 ore, quello di impianto di mAFP 15 minuti, mentre la durata mediana del supporto con mAFP 60 ore. Da un punto di vista fisiopatologico l’uso di mAFP rappresenta l’intervento ideale per[14]Bastos MB, Burkhoff D, Maly J, et al. Invasive left ventricle pressure-volume analysis: Overview and practical clinical implications. Eur Heart J 2020;41(12):1286–97:
- ripristinare la portata cardiaca, una perfusione tissutale adeguata e conseguente ripristino del metabolismo cellulare (nei pazienti con accoppiamento preservato tra macro e microcircolo);
- ridurre le pressioni di riempimento e la congestione polmonare;
- favorire l’“unloading” del ventricolo sinistro (LV) disfunzionante, riducendo il consumo di
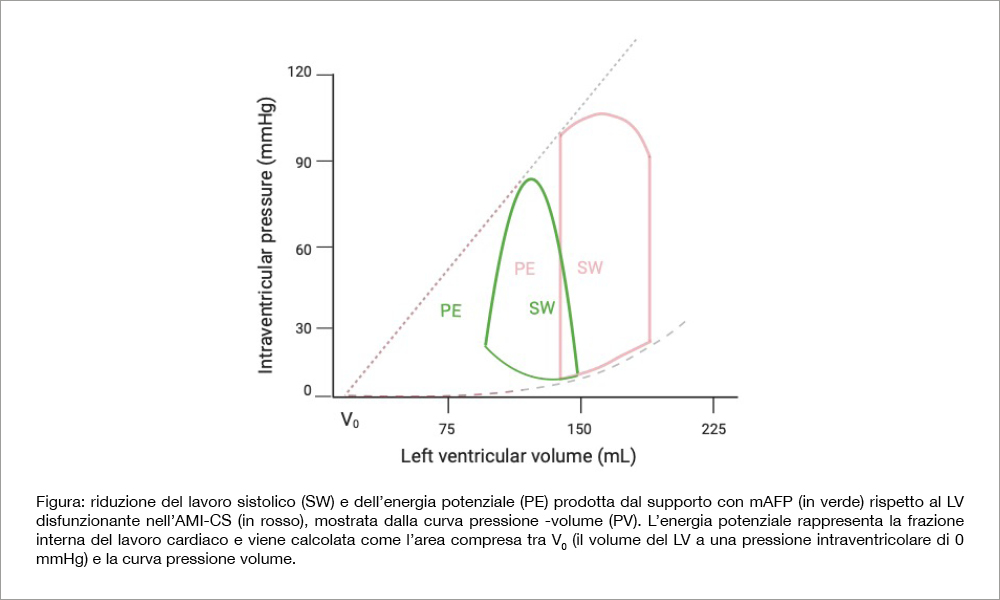
- ossigeno miocardico (soprattutto l’abolizione del periodo isovolumetrico comporta uno spostamento a sinistra e in basso della curva pressione-volume del LV disfunzionante, diminuendo così il lavoro sistolico e l’energia potenziale, come mostra la Figura).
Sulla base di queste premesse, non sorprende che il trattamento con mAFP abbia ridotto sia la mortalità per ogni causa a 6 mesi (HR 0.74, 95% CI 0.55-0.99, p=0.04) che l’outcome composito di “escalation” del trattamento verso altre forme di supporto circolatorio a breve o medio termine, trapianto cardiaco o morte a 6 mesi (HR 0.72, 95% CI 0.55-0.95). Tuttavia, l’uso di mAFP non era esente da complicazioni, come l’aumento significativo di terapia sostitutiva renale e di sepsi con emoculture positive (che tuttavia vanno interpretate nell’ambito di un bias da aumentata sopravvivenza) e da una aumentata incidenza di ischemia degli arti e da bleeding moderato e severo, condizioni che possono rappresentare un rischio di comorbilità a lungo termine nei pazienti AMI-CS sopravvissuti con supporto mAFP.
L’applicazione clinica dei risultati dello studio presenta alcune limitazioni:
- la durata del trial è stata superiore a 10 anni, essendo molto stretti i criteri di inclusione;
- la mediana del tempo di impianto del mAFP è stata di 15 minuti, indice di grande esperienza e capacità tecnica degli operatori nei centri partecipanti, non riscontrabile perciò in tutti i centri potenziali fruitori di questi dispositivi;
- il supporto con mAFP veniva continuato al flusso più elevato possibile per 48 ore, indipendentemente dal profilo emodinamico e dalle condizioni cliniche del paziente: ne può conseguire un aumento del carico di volume e di infusione di farmaci vasoattivi per “trattare la pompa” più che il paziente. Nella nostra esperienza è preferibile un approccio personalizzato piuttosto che standardizzato, limitando il supporto al flusso minimo e alla durata necessaria per migliorare la perfusione degli organi: questo sarà un argomento di ricerca da approfondire nel prossimo futuro;
- il management ottimale di cure intensive (inclusa la strategia di trattamento antitrombotico)
- di questi pazienti non è noto e resta dipendente dalla qualità dei vari centri;
- il beneficio clinico non sembra riguardare la popolazione femminile, che era tuttavia poco rappresentata (21%).
In conclusione, l’utilizzo di mAFP aumenterà sicuramente dopo la pubblicazione di risultati così promettenti e diverrà uno strumento di grande utilità nel trattamento dei pazienti AMI-CS; tuttavia, ci sono ancora domande che attendono risposte, quali la selezione dei pazienti e il trattamento ottimale durante il supporto emodinamico.
Bibliografia[+]
| ↑1 | De Luca L, Olivari Z, Farina A, et al. Temporal trends in the epidemiology, management, and outcome of patients with cardiogenic shock complicating acute coronary syndromes.Eur J Heart Fail. 2015;17:1124-32. doi:10.1002/ejhf.339. |
|---|---|
| ↑2 | Thiele H, Zeymer U, Thelemann N, et al. IABP-SHOCK II Investigators. Intraaortic Balloon Pump in Cardiogenic Shock Complicating Acute Myocardial Infarction: Long-Term 6-Year Outcome of the Randomized IABP-SHOCK II Trial. Circulation. 2019;139:395-403. doi:10.1161/CIRCULATIONAHA.118.038201; Thiele H, Zeymer U, Akin I, et al. ECLS-SHOCK Investigators. Extracorporeal Life Support in Infarct-Related Cardiogenic Shock. N Engl J Med. 2023;389:1286-1297. doi:10.1056/NEJMoa2307227 |
| ↑3 | Thiele H, Zeymer U, Akin I, et al. ECLS-SHOCK Investigators. Extracorporeal Life Support in Infarct-Related Cardiogenic Shock. N Engl J Med. 2023;389:1286-1297. doi:10.1056/NEJMoa2307227 |
| ↑4 | Thiele H, Zeymer U, Thelemann N, et al. IABP-SHOCK II Investigators. Intraaortic Balloon Pump in Cardiogenic Shock Complicating Acute Myocardial Infarction: Long-Term 6-Year Outcome of the Randomized IABP-SHOCK II Trial. Circulation. 2019;139:395-403. doi:10.1161/CIRCULATIONAHA.118.038201. |
| ↑5 | Marbach JA, Di Santo P, Kapur NK, et al. Lactate Clearance as a Surrogate for Mortality in Cardiogenic Shock: Insights From the DOREMI Trial. J Am Heart Assoc [Internet] 2022;11(6). Available from: https://www.ahajournals.org/ doi/10.1161/JAHA.121.023322. |
| ↑6 | Jentzer JC, van Diepen S, Barsness GW, et al. Cardiogenic Shock Classification to Predict Mortality in the Cardiac Intensive Care Unit. J Am Coll Cardiol [Internet] 2019;74(17):2117–28. Available from: https://linkinghub.elsevier.com/ retrieve/pii/S0735109719362916 |
| ↑7 | Mathew R, Di Santo P, Jung RG, et al. Milrinone as Compared with Dobutamine in the Treatment of Cardiogenic Shock. N Engl J Med 2021;385(6):516–25. |
| ↑8 | Parlow S, Santo P Di, Sterling LH, et al. Inotrope versus placebo therapy in cardiogenic shock: Rationale and study design of the CAPITAL DOREMI2 trial. Am Heart J [Internet] 2023;262:83–9. Available from: https://doi.org/10.1016/j.ahj.2023.04.010 |
| ↑9 | Thiele H, Zeymer U, Neumann F-J, et al. Intraaortic Balloon Support for Myocardial Infarction with Cardiogenic Shock. N Engl J Med [Internet] 2012;367(14):1287–96. Available from: http://www.nejm.org/doi/10.1056/NEJMoa1208410. |
| ↑10 | Thiele H, Zeymer U, Akin I, et al. Extracorporeal Life Support in Infarct-Related Cardiogenic Shock. N Engl J Med [Internet] 2023;389(14):1286–97. Available from: http://www.nejm.org/doi/10.1056/NEJMoa2307227 |
| ↑11 | Visconti LO, Camporotondo R, Ferlini M, Savastano S, Annoni G, Fasolino A. Il supporto della circolazione extracorporea nelle emergenze cardiologiche: evidenze scientifiche e pratica clinica. G Ital Cardiol (Rome) 2024;25(6):410–23; Baldetti L, Pagnesi M, Gramegna M, et al. Intra-Aortic Balloon Pumping in Acute Decompensated Heart Failure With Hypoperfusion: From Pathophysiology to Clinical Practice. Circ Hear Fail [Internet] 2021;14(11):E008527. Available from: https://www.ahajournals.org/doi/10.1161/CIRCHEARTFAILURE.121.008527. |
| ↑12 | Hochman JS, Sleeper LA, Webb JG, et al. Early Revascularization in Acute Myocardial Infarction Complicated by Cardiogenic Shock. N Engl J Med [Internet] 1999;341(9):625–34. Available from: http://www.nejm.org/doi/abs/10.1056/NEJM199908263410901 |
| ↑13 | Møller JE, Engstrøm T, Jensen LO, et al. Microaxial Flow Pump or Standard Care in Infarct-Related Cardiogenic Shock. N Engl J Med [Internet] 2024;390(15):1382–93. Available from: http://www.nejm.org/doi/10.1056/NEJMoa2312572 |
| ↑14 | Bastos MB, Burkhoff D, Maly J, et al. Invasive left ventricle pressure-volume analysis: Overview and practical clinical implications. Eur Heart J 2020;41(12):1286–97 |
Accedi per leggere tutto l'articolo
Inserisci i dati del tuo account su Cardiotalk per accedere e leggere tutto il contenuto dell'articolo.
Se non hai un account, clicca sul pulsante registrati e verrai reindirizzato al portale Cardiotalk per la registrazione.

