Stefano De Servi, Università degli Studi di Pavia
Inquadramento
Una delle limitazioni più temute dell’intervento di TAVI consiste nei dubbi sulla durabilità delle protesi, soprattutto quando impiantate in popolazioni a rischio medio-basso in alternativa alla chirurgia in pazienti non di età avanzata. Una corretta valutazione della problematica è stata ostacolata dalla mancanza di una definizione universalmente accettata di “deterioramento emodinamico della protesi valvolare” (HVD). Recentemente il Valve Academic Research Consortium-3 (VARC-3) ha proposto una definizione che tiene conto di una valutazione dinamica dei parametri emodinamici ottenuti all’esame ecocardiografico, che rappresenta un criterio univoco che permette di esaminare ampie casistiche sia prospettiche che retrospettive[1]VARC-3 Writing Committee, Genereux P, Piazza N, Alu MC, et al. Valve Academic Research Consortium 3: updated endpoint definitions for aortic valve clinical research. J Am Coll Cardiol. … Continua a leggere. Gli autori del trial hanno osservato una incidenza di disfunzione protesica di tipo strutturale almeno moderata nel 15.4% nei pazienti TAVI e nel 20.8% nei pazienti SAVR, una differenza non statisticamente significativa (P=0.20). Tuttavia, una severa disfunzione strutturale era più frequente nei pazienti SAVR (10% versus 1.5%, P=0.004). È interessante il dato, confortato da precedente letteratura[2]Rheude T, Pellegrini C, Cassese S, et al. Predictors of haemodynamic structural valve deterioration following transcatheter aortic valve implantation with latest-generation balloon expandable valves. … Continua a leggere che la terapia anticoagulante si associa significativamente al deterioramento emodinamico della protesi. È noto, infatti, che gli antagonisti della vitamina K possono accelerare la calcificazione dei lembi valvolari, probabilmente per una inattivazione della proteina di matrice GIa[3]Tastet L, Pibarot P, Shen M, et al. Oral Anticoagulation therapy and progression of calcific aortic valve stenosis. J Am Coll Cardiol. 2019;73:1869–1871., che agisce invece come inibitore della calcificazione.
Editoriale: “Deterioramento emodinamico (HVD) dopo trattamento transcatetere della stenosi valvolare aortica: come dobbiamo tenerne conto nella pratica clinica?”
A cura di: Marco Ferlini, SC Cardiologia 1, Fondazione IRCCS Policlinico San Matteo. Silvia Miette Pontremoli, Dipartimento di Medicina Molecolare, Università di Pavia
La sostituzione transcatetere della stenosi valvolare aortica (TAVR) ha rivoluzionato la gestione di questa patologia, con una espansone rapida che è partita dai pazienti inoperabili o ad alto rischio sino ad arrivare a quelli a rischio chirurgico intermedio e basso[4]Vahanian A, Beyersdorf F, Praz F, Milojevic M, Baldus S, Bauersachs J, Capodanno D, Conradi L, De Bonis M, De Paulis R, Delgado V, Freemantle N, Gilard M, Haugaa KH, Jeppsson A, Jüni P, Pierard L, … Continua a leggere. Tuttavia, con la crescente diffusione della procedura tra pazienti più giovani, l’attenzione si è spostata sulla durabilità a lungo termine delle protesi transcatetere utilizzate. In particolare, uno dei potenziali problemi clinicamente rilevanti in questo contesto è rappresentato dal deterioramento emodinamico della valvola (HVD), un fenomeno che può compromettere la longevità e l’efficacia della TAVR.
Incidenza del deterioramento emodinamico delle protesi transcatetere
La vera incidenza dell’HVD dopo TAVR è ancora oggetto di studio, a causa della variabilità delle definizioni utilizzate negli studi, degli avventi avversi concomitanti come la mortalità dei pazienti più anziani che limita la durata del follow-up, e infine dalla differente durata dei follow-up stessi. In risposta alla esigenza di standardizzazione il Valve Academic Research Consortium (VARC-3)[5]Capodanno D, Petronio AS, Prendergast B, Eltchaninoff H, Vahanian A, Modine T, Lancellotti P, Sondergaard L, Ludman PF, Tamburino C, Piazza N, Hancock J, Mehilli J, Byrne RA, Baumbach A, Kappetein … Continua a leggere, ha proposto una nuova classificazione per la disfunzione valvolare delle bioprotesi (Boprosthetic Valve Dysfunction – BVD), che integra aspetti anatomo-patologici, la rilevanza emodinamica e le implicazioni cliniche. A differenza delle precedenti classificazioni, questa nuova definizione si fonda sull’evoluzione temporale dei parametri ecocardiografici della protesi valvolare aortica, superando l’approccio basato su soglie fisse per identificare il HVD e le sue fasi. Quindi il concetto di HVD comprende tra i parametri l’aumento progressivo dei gradienti transvalvolari, il riscontro di insufficienza aortica o un peggioramento del vizio noto e il fallimento strutturale della valvola che ne compromette la funzione. Studi osservazionali e dati di registro suggeriscono che l’incidenza di HVD moderata o severa varia dal 3% al 10% a cinque anni, con dati più recenti che indicano incidenze più alte nei pazienti che ricevono valvole di generazione precedente o impiantate in modo subottimale[6]Pibarot P, Ternacle J, Jaber WA, Salaun E, Dahou A, Asch FM, Weissman NJ, Rodriguez L, Xu K, Annabi M-S, Guzzetti E, Beaudoin J, Bernier M, Leipsic J, Blanke P, Clavel M-A, Rogers E, Alu MC, Douglas … Continua a leggere.
Predittori e fisiopatologia
Tra i diversi predittori di HVD sono stati identificati dei fattori legati al paziente, dei fattori legati alla protesi e dei fattori procedurali. Tra i dati clinici influiscono la malattia renale cronica, l’anello aortico di piccole dimensioni, una piccola superficie corporea e la giovane età, in quanto risulta associata a una maggiore sollecitazione fisica della valvola nel tempo. Tra i fattori legati alla protesi vi sono la sottespansione, il malposizionamento e l’utilizzo di protesi di prima generazione con forza radiale limitata. Alcuni tipi di valvole sembrano inoltre poter favorire l’ispessimento dei lembi e la riduzione del movimento per trombosi dei cleft. Fattori procedurali: dimensionamento inadeguato, o necessità di post-dilatazione possono indurre anomalie strutturali o funzionali della protesi. Una trombosi subclinica dei lembi identificata tramite imaging (es. Tomografia Computerizzata a Quattro Dimensioni – 4D-CT), può portare poi ad aumenti dei gradienti e ridotta mobilità dei lembi. Se riscontrata in fase precoce, questo stadio di HVD che può rispondere alla terapia con anticoagulazione sistemica. L’interazione tra le anomalie nella meccanica, la calcificazione dei lembi e processi biologici, come infiammazione e trombosi, sembra quindi essere alla base della natura multifattoriale dell’HVD post-TAVR[7]Makkar RR, Blanke P, Leipsic J, Thourani V, Chakravarty T, Brown D, Trento A, Guyton R, Babaliaros V, Williams M, Jilaihawi H, Kodali S, George I, Lu M, McCabe JM, Friedman J, Smalling R, Wong SC, … Continua a leggere.
Esiti clinici e implicazioni
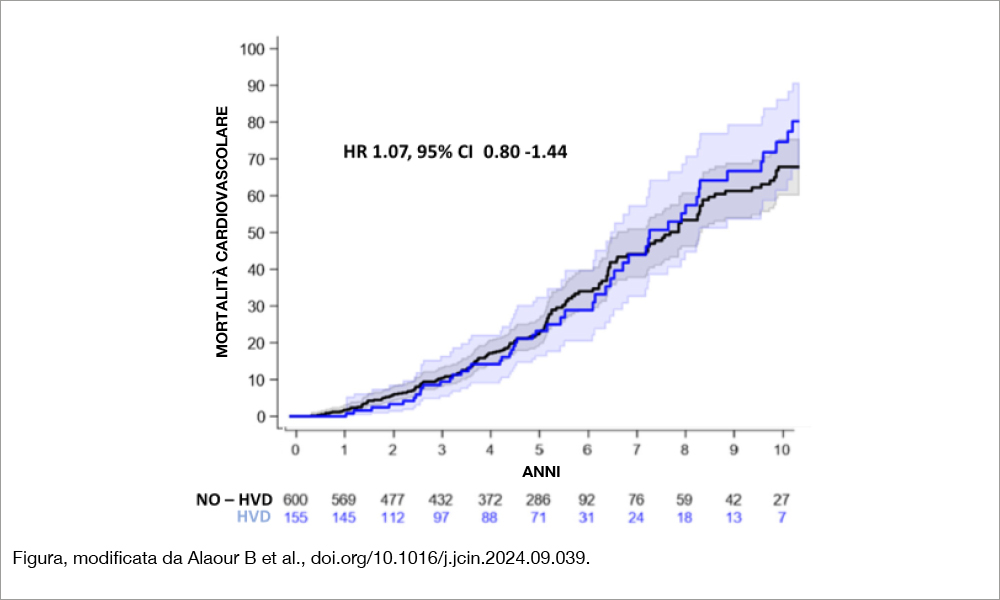
Sebbene un deterioramento lieve possa essere clinicamente silente, l’HVD di grado moderatosevero è associato a esiti avversi, inclusi sintomi progressivi di scompenso cardiaco, riospedalizzazioni e ridotta sopravvivenza[8]Fukui M, Bapat VN, Garcia S, Dworak MW, Hashimoto G, Sato H, Gössl M, Enriquez-Sarano M, Lesser JR, Cavalcante JL, Sorajja P. Deformation of Transcatheter Aortic Valve Prostheses: Implications for … Continua a leggere. Inoltre, l’HVD ha importanti implicazioni per la necessità di un possibile reintervento, specialmente nei pazienti più giovani con aspettativa di vita più lunga[9]Ternacle J, Hecht S, Eltchaninoff H, Salaun E, Clavel M-A, Côté N, Pibarot P. Durability of transcatheter aortic valve implantation. EuroIntervention 2024;20:e845–e864.. La ripetizione della TAVR (TAV-in-TAVR) e l’espianto chirurgico presentano numerose difficoltà tecniche e hanno rischi procedurali aumentati rispetto alla procedura primaria. È importante, inoltre, sottolineare pertanto che i pazienti con HVD possono anche non essere candidati ideali per essere sottoposti a un re-intervento, a causa di comorbidità o fattori anatomici[10]Baron SJ, Ryan MP, Chikermane SG, Thompson C, Clancy S, Gunnarsson CL. Long-term risk of reintervention after transcatheter aortic valve replacement. Am Heart J 2024;267:44–51. In un recente studio su oltre 2.400 pazienti seguiti per 10 anni[11]Alaour B, Tomii D, Nakase M, Heg D, Stortecky S, Lanz J, Samim D, Reineke D, Praz F, Windecker S, Pilgrim T. Hemodynamic Valve Deterioration After Transcatheter Aortic Valve Replacement: Incidence, … Continua a leggere, è stata riportata un’incidenza cumulativa di HVD sorprendentemente alta che dovrebbe richiamare l’attenzione sull’importanza di un attento monitoraggio a lungo termine. L’incidenza cumulativa di HVD di grado moderato o severo è risultata pari al 2.2% a 1 anno, 10.8% a 5 anni e 25.6% a 10 anni. In particolare, la forma più grave si è verificata nello 0.5%, 2.6% e 12.7% dei casi rispettivamente. Secondo la definizione VARC-3 di HVD si definisce HVD di grado moderato un incremento del gradiente transvavolare medio (PG med) ≥10 mmHg, con un PG med pari a ≥20 mmHg, con riduzione dell’area orifiziale effettiva (EOA) ≥0.3 cm2; mentre viene definito HVD severo un incremento del (PG med) ≥30 mmHg, con un PG med pari a ≥30 mmHg, con riduzione dell’area orifiziale effettiva (EOA) ≥0.6 cm2, oppure la comparsa o peggioramento di rigurgito intraprotesico. Sono stati esclusi i pazienti deceduti, con reintervento precoce (<3 mesi), con valve-in-valve, e con rigurgito aortico ≥ moderato alla dimissione, al fine di escludere una coorte di pazienti con impianto tecnicamente non riuscito o disfunzione precoce. I principali predittori indipendenti identificati sono stati: volume di calcio dell’aortic valve complex (AVC) (HR: 1.81; 95% CI: 1.11-2.97; P=0.018), rigurgito aortico residuo alla dimissione (HR: 1.87; 95% CI: 1.34-2.60; P<0.001), e trattamento con anticoagulanti orali (HR 1.78; 95% CI: 1.00-3.15; P=0.048). Per valutare le conseguenze cliniche dell’HVD, gli autori hanno costruito poi una coorte “case-control” matched 1:4, confrontando 155 pazienti con HVD con 600 pazienti senza deterioramento della bioprotesi. I due gruppi hanno mostrato tassi simili di mortalità per tutte le cause cardiovascolari, nonché di endocardite, ma una marcata differenza nel tasso di reintervento sulla valvola aortica (RR 4.81; p=0.001). In base ai risultati, pertanto, sebbene l’HVD sia associato a un aumento di cinque volte della necessità di reintervento, non è stato correlato a una maggiore mortalità totale o cardiovascolare, un dato che potrebbe orientare meglio le strategie di monitoraggio e intervento. Questo apparente “disaccopiamento” tra deterioramento emodinamico e peggioramento clinico potrebbe essere spiegato da diversi fattori: da un lato, l’HVD potrebbe avere un decorso subclinico e insidioso, dall’altro l’esecuzione della ecocardiografia al follow-up appare più probabile nei pazienti sintomatici L’entità della calcificazione dell’AVC e la presenza di rigurgito residuo alla dimissione sono entrambi meccanismi che possono causare stress cronico sulla protesi. Il ruolo degli anticoagulanti orali è invece più controverso: se da un lato possono ridurre il rischio di trombosi subclinica, dall’altro alcuni studi suggeriscono un possibile effetto pro-calcificante degli antagonisti della vitamina K[12]Bjørklund G, Svanberg E, Dadar M, Card DJ, Chirumbolo S, Harrington DJ, Aaseth J. The Role of Matrix Gla Protein (MGP) in Vascular Calcification. Curr Med Chem 2020;27:1647–1660; Tastet L, Pibarot … Continua a leggere.
I risultati di questo studio mettono in luce fattori di rischio potenzialmente modificabili e suggeriscono percorsi per strategie preventive future. Le implicazioni fisiopatologiche, in particolare legate al carico di calcio e all’interazione con la bioprotesi, meritano ulteriori approfondimenti e potrebbero influenzare la pianificazione preprocedurale o la scelta della protesi. Tuttavia, la natura osservazionale e il disegno monocentrico dello studio debbono comunque essere tenute in considerazione come limitazioni importanti nell’interpretazione dei risultati e nella loro estrapolazione nella pratica clinica.
Conclusioni
La HVD rappresenta pertanto una sfida emergente nei pazienti trattati con TAVR, in particolare nel trattamento dei pazienti giovani e a basso rischio. Una corretta comprensione di incidenza, predittori e implicazioni cliniche appare essenziale nell’ottimizzare la selezione dei pazienti, la scelta delle protesi e le strategie di follow-up. In una prospettiva futura appare essenziale focalizzarsi sulla durabilità delle protesi biologiche (transcatetere e chirurgiche), sui trattamenti antitrombotici da somministrare dopo la procedura e su un attento monitoraggio post-TAVR così da garantire risultati ottimali a lungo termine. Infine, i risultati del lavoro di Alaour et al.[13]Alaour B, Tomii D, Nakase M, Heg D, Stortecky S, Lanz J, Samim D, Reineke D, Praz F, Windecker S, Pilgrim T. Hemodynamic Valve Deterioration After Transcatheter Aortic Valve Replacement: Incidence, … Continua a leggere sottolineano l’importanza di strategie di follow-up il più individualizzate possibili con la necessità di un imaging standardizzato per tipo e per tempistica.
Bibliografia[+]
| ↑1 | VARC-3 Writing Committee, Genereux P, Piazza N, Alu MC, et al. Valve Academic Research Consortium 3: updated endpoint definitions for aortic valve clinical research. J Am Coll Cardiol. 2021;77(21):2717–2746. https://doi.org/10.1016/j.jacc.2021.02.038).
Lo studio in esameGli autori hanno considerato l’esperienza globale del centro di Berna relativa a pazienti sottoposti a TAVI tra l’agosto 2007 e il giugno 2022, escludendo i decessi e i reinterventi dei primi tre mesi oltre agli interventi di valve-in-valve e i pazienti con rigurgito aortico almeno moderato alla dimissione (procedure considerate non efficaci). Sono stati così considerati 2.403 pazienti, con età media di 81.8 anni, STS score 3.8% (nel 57% dei casi veniva impiantata una protesi valvolare balloon-expandable). L’HVD è stata considerata moderata (aumento del gradiente di almeno 10 mmHg tra l’ecocardio di controllo, eseguito ad almeno 3 mesi dalla dimissione, e quello alla dimissione) risultante in un gradiente medio di almeno 20 mmHg e concomitante riduzione dell’area orifiziale effettiva (EOA) di 0.3 cm2, oppure l’aumento di 1 grado nel rigurgito aortico risultante in una insufficienza aortica di grado moderato. L’HVD era considerata severa in presenza di un incremento del gradiente transaortico di almeno 20 mmHg, risultante in un gradiente medio di almeno 30 mmHg e in una riduzione di EOA di 0.6 cm2. È stata diagnosticata HVD moderata nel 5% dei pazienti, severa nell’1.9%. I pazienti con HVD erano meno frequentemente donne, avevano una superficie corporea minore rispetto ai pazienti senza HVD. Inoltre essi avevano una stenosi aortica più severa (gradiente basale più elevato), una più marcata componente calcifica della valvola e necessitavano con maggiore frequenza di postdilatazione. Non vi era, invece, differenza nel tipo di protesi impiantata nè nel gradiente medio transvalvolare all’ecocardio alla dimissione. Ai controlli ecocardiografici seriati, raccomandati a 1, 5, 10 e 15 anni dalla procedura, l’incidenza di HVD moderata o severa, a partire dal terzo mese post-TAVI, era a 1 anno del 2.2%, a 5 anni del 10.8% e a 10 anni del 25.6%, prevalentemente (82%) per la presenza di rigurgito aortico almeno moderato. All’analisi multivariata VHD si associava significativamente al volume di calcio valvolare, presenza di rigurgito aortico alla dimissione, trattamento con anticoagulanti. I pazienti con HVD (n=155) sono stati matchati, con un rapporto 1:4 con 600 pazienti senza HVD sulla base del sesso, fascia di età, tipo di protesi impiantata (balloon expandable versus self-expanding). I pazienti con HVD hanno avuto mortalità per ogni causa e cardiovascolare non significativamente differente rispetto a quelli senza HVD (vedi Figura), ma hanno avuto una maggiore necessità di reintervento (1.3% vs 0.3%, rate ratio 4.81; 95% CI: 1.74-13.3; P=0.001). Take home messageUn deterioramento emodinamico della protesi valvolare nei pazienti sottoposti a TAVI si verifica in circa un quarto dei pazienti a un follow-up di 10 anni e si associa a un maggior rischio di reintervento. Interpretazione dei datiIl merito principale dello studio è quello di aver utilizzato criteri per la definizione di deterioramento emodinamico della valvola protesica codificati dal Valve Academic Research Consortium-3 (VARC-3), così da permettere confronti con serie analoghe di pazienti TAVI. Sulla reale incidenza del fenomeno restano dubbi, soprattutto per le difficoltà relative al rischio competitivo rappresentato dalla mortalità. Se si analizzano serie di pazienti in cui, come nel registro di Berna, pochi pazienti sopravvivono al di là del quinto anno di followup, esprimere giudizi sulla longevità delle protesi risulta piuttosto arduo. Non è noto poi se la causa del decesso fosse correlata a una disfunzione valvolare oppure semplicemente il risultato di una casistica di pazienti con età avanzata (l’età media era di quasi 82 anni). Inoltre, l’incidenza della disfunzione valvolare potrebbe essere dipesa dalla frequenza dei controlli ecocardiografici, se questi non sono temporalmente prestabiliti. Infatti, soprattutto a distanza dall’intervento, gli esami ecocardiografici potrebbero essere più frequenti nei pazienti che sviluppano sintomi, mentre i pazienti asintomatici non eseguirebbero l’indagine. Questa considerazione potrebbe spiegare l’impennata di casi di deterioramento emodinamico valvolare moderato/severo osservati tra 5 e 10 anni (dal 10.8% al 25.6%). Più interessanti e attendibili sono i dati della letteratura in pazienti a rischio minore, soprattutto se paragonati in confronto randomizzato con la sostituzione valvolare chirurgica (SAVR) e con controlli ecocardiografici prefissati. Lo studio NOTION, che ha randomizzato pazienti con rischio intermedio/ basso per la chirurgia a TAVI (n=145) o a SAVR (n=135), ha valutato la durabilità delle protesi a 10 anni utilizzando i criteri VARC-3((Thyregod HGH, Jorgensen TH, Ihlemann N, et al. Transcatheter or surgical aortic valve implantation:10-year outcomes of the NOTION trial.Eur Heart J. 2024;45:1116–1124. |
|---|---|
| ↑2 | Rheude T, Pellegrini C, Cassese S, et al. Predictors of haemodynamic structural valve deterioration following transcatheter aortic valve implantation with latest-generation balloon expandable valves. EuroIntervention. 2020;15:1233–1239. |
| ↑3 | Tastet L, Pibarot P, Shen M, et al. Oral Anticoagulation therapy and progression of calcific aortic valve stenosis. J Am Coll Cardiol. 2019;73:1869–1871. |
| ↑4 | Vahanian A, Beyersdorf F, Praz F, Milojevic M, Baldus S, Bauersachs J, Capodanno D, Conradi L, De Bonis M, De Paulis R, Delgado V, Freemantle N, Gilard M, Haugaa KH, Jeppsson A, Jüni P, Pierard L, Prendergast BD, Sádaba JR, Tribouilloy C, Wojakowski W, ESC/EACTS Scientific Document Group. 2021 ESC/EACTS Guidelines for the management of valvular heart disease. Eur Heart J 2022;43:561–632.; Mack MJ, Leon MB, Thourani VH, Makkar R, Kodali SK, Russo M, Kapadia SR, Malaisrie SC, Cohen DJ, Pibarot P, Leipsic J, Hahn RT, Blanke P, Williams MR, McCabe JM, Brown DL, Babaliaros V, Goldman S, Szeto WY, Genereux P, Pershad A, Pocock SJ, Alu MC, Webb JG, Smith CR, PARTNER 3 Investigators. Transcatheter Aortic-Valve Replacement with a Balloon-Expandable Valve in Low-Risk Patients. N Engl J Med 2019;380:1695–1705; Popma JJ, Deeb GM, Yakubov SJ, Mumtaz M, Gada H, ÒHair D, Bajwa T, Heiser JC, Merhi W, Kleiman NS, Askew J, Sorajja P, Rovin J, Chetcuti SJ, Adams DH, Teirstein PS, Zorn GL, Forrest JK, Tchétché D, Resar J, Walton A, Piazza N, Ramlawi B, Robinson N, Petrossian G, Gleason TG, Oh JK, Boulware MJ, Qiao H, Mugglin AS, Reardon MJ, Evolut Low Risk Trial Investigators. Transcatheter Aortic-Valve Replacement with a Self-Expanding Valve in Low-Risk Patients. N Engl J Med 2019;380:1706–1715 |
| ↑5 | Capodanno D, Petronio AS, Prendergast B, Eltchaninoff H, Vahanian A, Modine T, Lancellotti P, Sondergaard L, Ludman PF, Tamburino C, Piazza N, Hancock J, Mehilli J, Byrne RA, Baumbach A, Kappetein AP, Windecker S, Bax J, Haude M. Standardized definitions of structural deterioration and valve failure in assessing long-term durability of transcatheter and surgical aortic bioprosthetic valves: a consensus statement from the European Association of Percutaneous Cardiovascular Interventions (EAPCI) endorsed by the European Society of Cardiology (ESC) and the European Association for Cardio-Thoracic Surgery (EACTS). Eur J Cardiothorac Surg 2017;52:408–417.; VARC-3 WRITING COMMITTEE:, Généreux P, Piazza N, Alu MC, Nazif T, Hahn RT, Pibarot P, Bax JJ, Leipsic JA, Blanke P, Blackstone EH, Finn MT, Kapadia S, Linke A, Mack MJ, Makkar R, Mehran R, Popma JJ, Reardon M, Rodes-Cabau J, Van Mieghem NM, Webb JG, Cohen DJ, Leon MB. Valve Academic Research Consortium 3: Updated Endpoint Definitions for Aortic Valve Clinical Research. J Am Coll Cardiol 2021;77:2717–2746 |
| ↑6 | Pibarot P, Ternacle J, Jaber WA, Salaun E, Dahou A, Asch FM, Weissman NJ, Rodriguez L, Xu K, Annabi M-S, Guzzetti E, Beaudoin J, Bernier M, Leipsic J, Blanke P, Clavel M-A, Rogers E, Alu MC, Douglas PS, Makkar R, Miller DC, Kapadia SR, Mack MJ, Webb JG, Kodali SK, Smith CR, Herrmann HC, Thourani VH, Leon MB, Hahn RT, PARTNER 2 Investigators. Structural Deterioration of Transcatheter Versus Surgical Aortic Valve Bioprostheses in the PARTNER-2 Trial. J Am Coll Cardiol 2020;76:1830–1843.; Blackman DJ, Saraf S, MacCarthy PA, Myat A, Anderson SG, Malkin CJ, Cunnington MS, Somers K, Brennan P, Manoharan G, Parker J, Aldalati O, Brecker SJ, Dowling C, Hoole SP, Dorman S, Mullen M, Kennon S, Jerrum M, Chandrala P, Roberts DH, Tay J, Doshi SN, Ludman PF, Fairbairn TA, Crowe J, Levy RD, Banning AP, Ruparelia N, Spence MS, Hildick-Smith D. Long-Term Durability of Transcatheter Aortic Valve Prostheses. J Am Coll Cardiol 2019;73:537–545. |
| ↑7 | Makkar RR, Blanke P, Leipsic J, Thourani V, Chakravarty T, Brown D, Trento A, Guyton R, Babaliaros V, Williams M, Jilaihawi H, Kodali S, George I, Lu M, McCabe JM, Friedman J, Smalling R, Wong SC, Yazdani S, Bhatt DL, Bax J, Kapadia S, Herrmann HC, Mack M, Leon MB. Subclinical Leaflet Thrombosis in Transcatheter and Surgical Bioprosthetic Valves: PARTNER 3 Cardiac Computed Tomography Substudy. J Am Coll Cardiol 2020;75:3003–3015 |
| ↑8 | Fukui M, Bapat VN, Garcia S, Dworak MW, Hashimoto G, Sato H, Gössl M, Enriquez-Sarano M, Lesser JR, Cavalcante JL, Sorajja P. Deformation of Transcatheter Aortic Valve Prostheses: Implications for Hypoattenuating Leaflet Thickening and Clinical Outcomes. Circulation 2022;146:480–493. |
| ↑9 | Ternacle J, Hecht S, Eltchaninoff H, Salaun E, Clavel M-A, Côté N, Pibarot P. Durability of transcatheter aortic valve implantation. EuroIntervention 2024;20:e845–e864. |
| ↑10 | Baron SJ, Ryan MP, Chikermane SG, Thompson C, Clancy S, Gunnarsson CL. Long-term risk of reintervention after transcatheter aortic valve replacement. Am Heart J 2024;267:44–51 |
| ↑11, ↑13 | Alaour B, Tomii D, Nakase M, Heg D, Stortecky S, Lanz J, Samim D, Reineke D, Praz F, Windecker S, Pilgrim T. Hemodynamic Valve Deterioration After Transcatheter Aortic Valve Replacement: Incidence, Predictors, and Clinical Outcomes. JACC Cardiovasc Interv 2025;18:72–85. |
| ↑12 | Bjørklund G, Svanberg E, Dadar M, Card DJ, Chirumbolo S, Harrington DJ, Aaseth J. The Role of Matrix Gla Protein (MGP) in Vascular Calcification. Curr Med Chem 2020;27:1647–1660; Tastet L, Pibarot P, Shen M, Clisson M, Côté N, Salaun E, Arsenault M, Bédard É, Capoulade R, Puri R, Poirier P, Clavel M-A. Oral Anticoagulation Therapy and Progression of Calcific Aortic Valve Stenosis. J Am Coll Cardiol 2019; 73:1869–1871.; Salaun E, Mahjoub H, Girerd N, Dagenais F, Voisine P, Mohammadi S, Yanagawa B, Kalavrouziotis D, Juni P, Verma S, Puri R, Coté N, Rodés-Cabau J, Mathieu P, Clavel M-A, Pibarot P. Rate, Timing, Correlates, and Outcomes of Hemodynamic Valve Deterioration After Bioprosthetic Surgical Aortic Valve Replacement. Circulation 2018;138:971–985 |
Accedi per leggere tutto l'articolo
Inserisci i dati del tuo account su Cardiotalk per accedere e leggere tutto il contenuto dell'articolo.
Se non hai un account, clicca sul pulsante registrati e verrai reindirizzato al portale Cardiotalk per la registrazione.

