Inquadramento
Mentre l’evenienza di un ictus dopo impianto transcatetere di bioprotesi aortica (TAVI) è relativamente infrequente (circa il 3% dei casi) lesioni cerebrali silenti (SBI) sono presenti alla risonanza magnetica nucleare (MRI) in una percentuale elevata di casi[1]De Carlo M, Liga R, Migaleddu G, et al. Evolution, Predictors, and Neurocognitive Effects of Silent Cerebral Embolism During Transcatheter Aortic Valve Replacement. JACC Cardiovasc Interv. … Continua a leggere. L’argomento è molto dibattuto, in particolare si discute sulla possibile correlazione tra queste lesioni periprocedurali e il successivo sviluppo di deficit cognitivo. Journal Map si è già occupato di questa problematica (vedi n. 9, intervista a Marco De Carlo), che tuttavia si arricchisce, anche in tempi brevi, di nuove esperienze e analisi.
Lo studio in esame
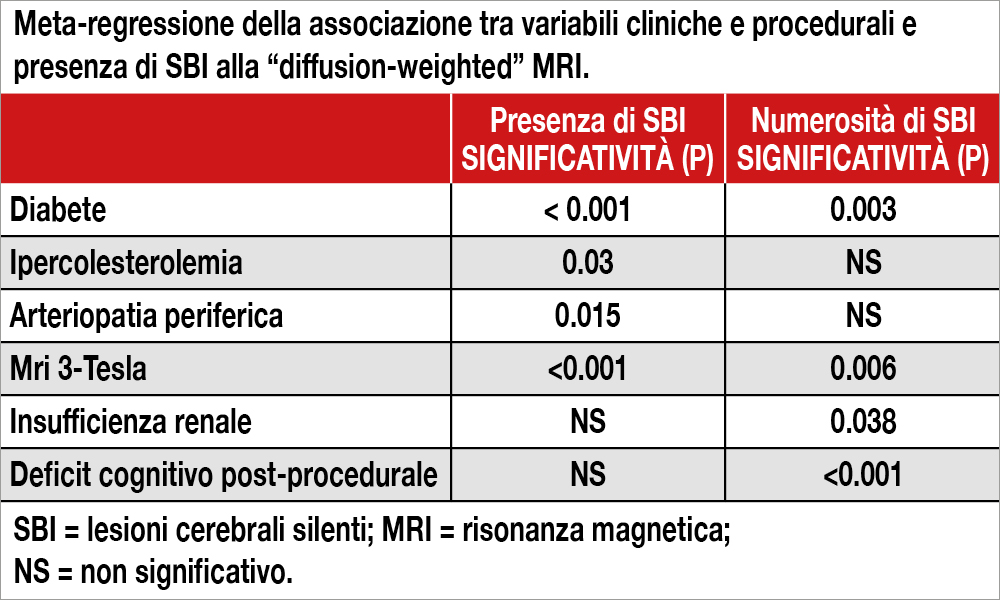
Gli Autori hanno effettuato una meta-analisi che ha considerato 39 studi in cui era stata eseguita “diffusion-weighted” MRI dopo una procedura di TAVI per evidenziare la presenza e la dimensione di eventuali SBI e la loro correlazione con lo sviluppo di deficit cognitivo. Dei 2.171 pazienti inclusi, 1.601 mostravano almeno una nuova SBI (73.7%). La meta-regressione mostrava come la presenza di diabete, insufficienza renale cronica, una pre-dilatazione, oltre a una attrezzatura MRI più performante (3-Tesla MRI) si associavano significativamente con il rischio di SBI (Tabella). Il deficit cognitivo si aggravava a breve termine ed era correlato con il numero di nuovi SBI. L’utilizzo dei dispositivi di protezione embolica non diminuiva il numero, ma riduceva le dimensioni di SBI.
Take home message
SBI sono presenti in almeno il 70% dei pazienti sottoposti a TAVI, favoriti dalla presenza di diabete, insufficienza renale e dalla pre-dilatazione. Il numero di SBI si correla con lo sviluppo di successivo deficit cognitivo e non sembra essere ridotto dall’uso dei dispositivi di protezione embolica.
Interpretazione dei dati
Come sottolineano gli Autori nella Discussione del lavoro, la genesi di SBI è multifattoriale, riconoscendo come meccanismi potenziali il tromboembolismo, la disfunzione ventricolare sinistra e lo scompenso cardiaco oltre ad alcuni aspetti procedurali come le microembolie in corso di pre-dilatazione della valvola prima dell’inserimento della protesi e l’ipoperfusione secondaria al pacing ventricolare rapido. Controverso appare il dato della correlazione tra SBI e comparsa o progressione di deficit cognitivo che necessiterebbe di tempi di follow-up più lunghi di quelli considerati nella presente meta-analisi. Nell’editoriale di accompagnamento Reed e coll.[2]Reed GW, Krishnaswamy A, Kapadia SR: Silent brain infarction after TAVR: common but of unclear significance. Editorial. Eur Heart J 2021; 42:1016–1018. sottolineano come, dall’analisi del SENTINEL trial[3]Lazar RM, Pavol MA, Bormann T, et al. Neurocognition and cerebral lesion burden in high-risk patients before undergoing transcatheter aortic valve replacement: insights from the SENTINEL trial. JACC … Continua a leggere, gli SBI spontanei (riconosciuti in una MRI pre-TAVI grazie alla tecnica FLAIR) abbiano un maggior impatto negativo sul deficit cognitivo di quelli procedurali. Quindi tempistica e tipologia di MRI sono fattori importanti per un corretto inquadramento del problema. Altro aspetto controverso, secondo gli editorialisti[4]Reed GW, Krishnaswamy A, Kapadia SR: Silent brain infarction after TAVR: common but of unclear significance. Editorial. Eur Heart J 2021; 42:1016–1018. è la correlazione tra SBI e utilizzo dei dispositivi di protezione embolica. Se ci si attiene agli studi randomizzati, per quanto limitati per numero di pazienti inclusi, sembrerebbe esservi una significativa riduzione del volume degli SBI procedurali. Una risposta definitiva verrà dallo studio PROTECTED TAVR che arruolerà circa 3.000 pazienti randomizzati all’utilizzo o no di questi dispositivi.
L’opinione di Carmen Spaccarotella
Policlinico Universitario Università Magna Graecia Catanzaro
Lo stroke peri e post-procedurale resta una delle complicanze più temute dopo TAVI. Con il miglioramento dei device e con l‘aumento del numero di pazienti trattati, la sua percentuale varia tra il 3-10%. Negli anni vi è stata una riduzione delle percentuali di stroke: come documentato dal registro STS-ACC TVT (Society of Thoracic Surgeons–American College of Cardiology Transcatheter Valve Therapy Registry)[5]Carroll JD, Mack MJ, Vemulapalli S, et al. STS-ACC TVT Registry of Transcatheter Aortic Valve Replacement. JACC VOL. 76, NO. 21, 2020. la percentuale di stroke si è ridotta dal 2011 al 2019 passando da 2.7% a 2.3%. Più marcata la riduzione per le TAVI eseguite per via transfemorale rispetto alla chirurgia[6]Lazar RM, Pavol MA, Bormann T, et al. Neurocognition and cerebral lesion burden in high-risk patients before undergoing transcatheter aortic valve replacement: insights from the SENTINEL trial. JACC … Continua a leggere. Trattando i pazienti a basso rischio che presentano minori comorbidità, la percentuale si riduce ancora di più <2%). La meta-analisi di Woldendorp e coll, pubblicata recentemente su European Heart Journal, tocca un tema molto discusso negli ultimi anni: il significato clinico e prognostico dell’infarto cerebrale silente dopo TAVI. L’articolo si pone due scopi: valutare se esistono dei fattori di rischio che aumentino la possibilità di sviluppare ischemia silente e se queste lesioni ischemiche possano influenzare le funzioni cognitive post-procedurali. Dai dati della letteratura sono stati identificati 39 studi che hanno arruolato in tutto 2.408 pazienti. L’incidenza di stroke con residui neurologici focali è stata del 3%. Lo studio ha documentato che la presenza di diabete mellito, l’utilizzo di una MRI di 3 Tesla, la presenza di insufficienza renale cronica e la predilatazione valvolare aortica, sono associati a un aumentato rischio di infarti silenti. D’altra parte, sia il diabete mellito che l’insufficienza renale cronica sono considerati per sé condizioni ad alto rischio per ischemia cerebrale, mentre altri fattori come la vasculopatia periferica non sono correlati a un aumento di infarti silenti, probabilmente per una bassa probabilità di embolia retrograda durante TAVI. La certezza sui fattori di rischio che possono incrementare la presenza di infarti silenti è difficile: le eziologie sono diverse e includono fattori generali legati al paziente, come tromboembolia, una severa disfunzione ventricolare sinistra e insufficienza cardiaca, nonché fattori procedurali specifici come generazione e migrazione di microemboli durante la predilatazione e l’inserzione valvolare oppure la ipoperfusione durante il rapid pacing. I pazienti candidati a TAVI rappresentano un gruppo molto eterogeneo e l’alta prevalenza di questi fattori di rischio rende difficile isolare i pazienti “a rischio”. In questo studio la presenza di deficit cognitivi post procedurali aumenta durante il follow-up: dal 16% a circa 10 giorni al 26% a 6 mesi, documentando una correlazione tra numero medio di infarti silenti e peggioramento dei disturbi cognitivi. I dati sulla funzione cognitiva sono influenzati da fattori sottostanti legati fondamentalmente ad altre patologie come in caso di fibrillazione atriale. Dopo interventi di cardiochirurgia vi è un declino cognitivo precoce che sembra essere legato soprattutto a fenomeni di infiammazione sistemica e neuro-ormonale post-intervento, eziologie diverse rispetto agli infarti silenti post-TAVI. La problematica degli infarti silenti è ampia, perché un loro riscontro è presente anche in caso di posizionamento di endoprotesi aortiche o addirittura in caso di procedure routinarie come angioplastiche: il contributo della dilatazione valvolare e del rilascio sembra quindi ridimensionato se si fanno queste considerazioni. I dati in letteratura sugli infarti silenti evidenziano, in pratica, una discrepanza tra incidenza degli eventi e possibilità di influenzare la prognosi. In alcuni casi la rivalutazione mediante MRI in follow-up ha evidenziato la possibilità di una netta riduzione del numero e del volume degli infarti cerebrali con scarsa influenza sulla prognosi[7]Giustino G, Sorrentino S, Mehran R, Faggioni M, Dangas G. Cerebral Embolic Protection During TAVR: A Clinical Event Meta-Analysis. J Am Coll Cardiol. 2017 Jan 31;69(4):465-466. doi: … Continua a leggere. È importante sottolineare come il numero di infarti silenti sia decisamente elevato rispetto alla evidenza clinica (circa 70%)[8]De Carlo M, Liga R, Migaleddu G, et al. Evolution, Predictors, and Neurocognitive Effects of Silent Cerebral Embolism During Transcatheter Aortic Valve Replacement. JACC Cardiovasc Interv. … Continua a leggere[9]Reed GW, Krishnaswamy A, Kapadia SR: Silent brain infarction after TAVR: common but of unclear significance. Editorial. Eur Heart J 2021; 42:1016–1018.[10]Lazar RM, Pavol MA, Bormann T, et al. Neurocognition and cerebral lesion burden in high-risk patients before undergoing transcatheter aortic valve replacement: insights from the SENTINEL trial. JACC … Continua a leggere[11]Carroll JD, Mack MJ, Vemulapalli S, et al. STS-ACC TVT Registry of Transcatheter Aortic Valve Replacement. JACC VOL. 76, NO. 21, 2020.[12]Giustino G, Sorrentino S, Mehran R, Faggioni M, Dangas G. Cerebral Embolic Protection During TAVR: A Clinical Event Meta-Analysis. J Am Coll Cardiol. 2017 Jan 31;69(4):465-466. doi: … Continua a leggere. Un altro argomento interessante, trattato nel paper, riguarda l’utilizzo di sistemi di protezione cerebrale (CEPD). Il loro utilizzo influenza il volume degli infarti silenti, ma non la loro incidenza. La prevenzione dell’ictus rimane un’opportunità chiave per migliorare gli esiti della TAVI e c’è un intenso interesse per i CEPD per mitigare questo rischio. Alla luce di quanto sopra, è necessario un ampio studio clinico per comprendere il significato clinico a breve e lungo termine di infarti cerebrali silenti post-TAVI e se il rischio di infarti silenti e ictus può essere ridotto con i CEPD rimane poco chiaro[13]Giustino G, Sorrentino S, Mehran R, Faggioni M, Dangas G. Cerebral Embolic Protection During TAVR: A Clinical Event Meta-Analysis. J Am Coll Cardiol. 2017 Jan 31;69(4):465-466. doi: … Continua a leggere. Nonostante questo e nonostante i CEPD siano più semplici da usare, sono ancora pochi i centri in Italia che utilizzano in via routinaria i sistemi di protezione durante TAVI. In conclusione, gli infarti cerebrali silenti sono più frequenti rispetto allo stroke vero e proprio. La sfida futura è stabilire quanto questi infarti silenti gravano sulla prognosi. Inoltre, come sottolinea l’editoriale all’articolo in oggetto[14]Reed GW, Krishnaswamy A, Kapadia SR: Silent brain infarction after TAVR: common but of unclear significance. Editorial. Eur Heart J 2021; 42:1016–1018., la corrispondenza tra volume degli infarti cerebrali e declino cognitivo precoce potrebbe indicare un valore soglia oltre il quale l’infarto potrebbe non essere più molto silente e quindi far rientrare in gioco la necessità di usare i sistemi di protezione che, comunque, riducono il volume degli infarti. A complicare ancora di più le cose vi è la problematica degli infarti silenti “spontanei” cioè non legati a procedure[15]Reed GW, Krishnaswamy A, Kapadia SR: Silent brain infarction after TAVR: common but of unclear significance. Editorial. Eur Heart J 2021; 42:1016–1018.. Concettualmente, gli infarti silenti procedurali potrebbero avere un minore impatto prognostico, poiché la ragione scatenante è episodica, mentre quelli spontanei possono essere dovuti a comorbidità legate al paziente (come malattie cerebrovascolari) con maggiori possibilità di ricorrenza e di declino cognitivo.
Sicuramente un’attenta valutazione di tutte le comorbidità legate agli infarti silenti è particolarmente importante soprattutto perché la TAVI tratterà sempre di più pazienti “a basso rischio” che hanno meno comorbidità, una funzione cognitiva più elevata e una maggiore aspettativa di vita: soprattutto per questi pazienti sarà importante stabilire una possibile correlazione con la prognosi.
Considerazioni
- Lo stroke peri e post-procedurale resta una delle complicanze più temute della TAVI.
- La percentuale di stroke si è ridotta dal 2011 al 2019 passando da 2.7% a 2.3%.
- L’incidenza di infarti cerebrali silenti è elevata rispetto all’evidenza clinica (circa 70%).
- Alcuni fattori di rischio come il diabete mellito, l’insufficienza renale cronica, la predilatazione valvolare aumentano l’incidenza di infarti cerebrali silenti.
- Il volume degli infarti silenti sembra essere correlato (non chiaramente) con le funzioni cognitive.
- L’utilizzo di sistemi di protezione cerebrale riduce il volume degli infarti, ma non il numero. Qualsiasi effetto sugli endpoint clinici “hard” rimane poco chiaro.
- La diagnosi viene effettuata con MRI e la potenza utilizzata (3 Tesla) incide anche sul numero di infarti cerebrali silenti.
- Eseguire MRI in tutti i pazienti sottoposti a TAVI aumenta i costi e prolunga il ricovero dei pazienti.
- Nel follow-up a lungo termine alcuni dati in letteratura mostrano una riduzione del numero e del volume degli infarti silenti. Altri dati, invece, indicano un peggioramento delle funzioni cognitive.
- La problematica degli infarti silenti è ampia, perché un loro riscontro è presente anche in caso di posizionamento di endoprotesi aortiche o, addirittura, in caso di procedure routinarie come le angioplastiche coronariche.
Bibliografia[+]
| ↑1, ↑8 | De Carlo M, Liga R, Migaleddu G, et al. Evolution, Predictors, and Neurocognitive Effects of Silent Cerebral Embolism During Transcatheter Aortic Valve Replacement. JACC Cardiovasc Interv. 2020;13:1291-1300. doi: 10.1016/j.jcin.2020.03.004. |
|---|---|
| ↑2, ↑4, ↑9, ↑14, ↑15 | Reed GW, Krishnaswamy A, Kapadia SR: Silent brain infarction after TAVR: common but of unclear significance. Editorial. Eur Heart J 2021; 42:1016–1018. |
| ↑3, ↑6, ↑10 | Lazar RM, Pavol MA, Bormann T, et al. Neurocognition and cerebral lesion burden in high-risk patients before undergoing transcatheter aortic valve replacement: insights from the SENTINEL trial. JACC Cardiovasc Interv 2018;11:384–392. |
| ↑5, ↑11 | Carroll JD, Mack MJ, Vemulapalli S, et al. STS-ACC TVT Registry of Transcatheter Aortic Valve Replacement. JACC VOL. 76, NO. 21, 2020. |
| ↑7, ↑12, ↑13 | Giustino G, Sorrentino S, Mehran R, Faggioni M, Dangas G. Cerebral Embolic Protection During TAVR: A Clinical Event Meta-Analysis. J Am Coll Cardiol. 2017 Jan 31;69(4):465-466. doi: 10.1016/j.jacc.2016.12.002. |
Accedi per leggere tutto l'articolo
Inserisci i dati del tuo account su Cardiotalk per accedere e leggere tutto il contenuto dell'articolo.
Se non hai un account, clicca sul pulsante registrati e verrai reindirizzato al portale Cardiotalk per la registrazione.

