Inquadramento
La riperfusione spontanea negli infarti STEMI è un segnale favorevole che si accompagna a infarti di dimensioni ridotte e a una buona prognosi anche a distanza[1]Fefer P, Beigel R, Atar S, et al. Outcomes of patients presenting with clinical indices of spontaneous reperfusion in ST-elevation acute coronary syndrome undergoing deferred angiography. J Am Heart … Continua a leggere. Il fenomeno è stato messo in correlazione con una più potente attività fibrinolitica e a alla presenza di un trombo occlusivo con tralci fibrinici meno densi rispetto ai trombi che non riperfondono spontaneamente[2]Genoud V, Lauricella AM, Kordich LC, Quintana I. Impact of homocysteine-thiolactone on plasma fibrin networks. J Thromb Thrombolysis. 2014;38:540–545.. Tuttavia uno studio ampio che consideri biomarker di coagulazione, attività fibrinolitica endogena e correlati clinici e prognostici nei pazienti STEMI nei pazienti con riperfusione spontanea non è stato sinora condotto.
Lo studio in esame
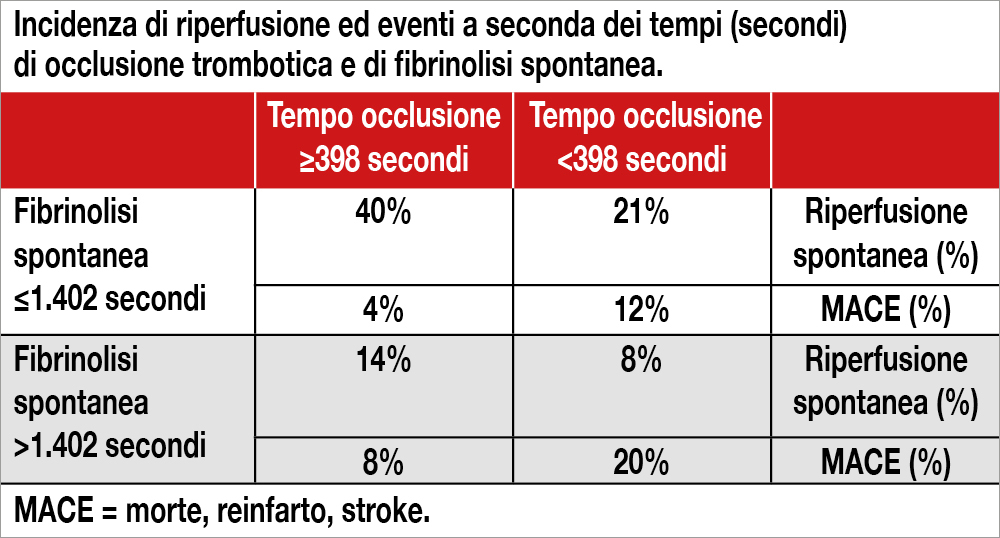
Studio prospettico che ha incluso 801 pazienti STEMI (il 18% con riperfusione spontanea) nei quali prima della PCI e della somministrazione di anticoagulanti (ma dopo la somministrazione della doppia antiaggregazione per os), sono stati misurati i tempi di occlusione (OT determinato con il Global Thrombosis Test, Thromboquest Ltd, che misura il tempo di occlusione del sangue nel passaggio attraverso due cuscinetti a sfera) e di lisi spontanea (SLT, misurato con lo stesso strumento alla ricomparsa del flusso). I pazienti con riperfusione spontanea (definita come presenza di flusso TIMI 3 all’angiografia prima della PCI) non differivano dagli altri pazienti per caratteristiche cliniche eccetto per una leucocitosi meno marcata e un rapporto piastrine/linfociti più alto. Il picco di troponina era significativamente ridotto nei pazienti con riperfusione spontanea, così come risultava meno estesa la coronaropatia. Non si riscontrava alcuna differenza tra i due gruppi quanto ai tempi di intervento (tempo di ischemia, door to balloon, tempo di assunzione doppia terapia antiaggregante). I pazienti con riperfusione spontanea avevano OT più lunghi (435 secondi vs 366 secondi; P<0.001) e SLT più brevi (1.257 secondi vs 1.616 secondi; P<0.001) rispetto ai pazienti con TIMI 0-2 all’angiografia. Quest’ultimo parametro era, tuttavia, miglior predittore della riperfusione spontanea (area sotto la curva SLT: 0.707; 95% CI: 0.661-0.753; area sotto la curva OT: 0.629; 95% CI: 0.581- 0.677). Tra i pazienti con OT ≥398 secondi e LTS ≤1.402 secondi,il 43% aveva una riperfusione spontanea, rispetto al 14% dei pazienti con OT <398 secondi e SLT >1.402 secondi (vedi Tabella). I valori più alti di OT e più brevi di SLT si riscontravano nei pazienti con risoluzione di ST completa. Gli eventi cardiovascolari maggiori (MACE = morte, reinfarto, stroke) a 4 anni risultavano più numerosi nei pazienti senza riperfusione spontanea (10.6% vs 4.1%; P=0.013), soprattutto in quelli con risoluzione completa di ST (10.1% vs 1.5%; P=0.029). Inoltre, i pazienti con LTS ≥1.800 secondi avevano maggiori probabilità di sperimentare MACE rispetto ai pazienti con LTS <1,800 secondi (HR: 3.9; 95% CI: 2.5-6.3; P<0.001), così come quelli con OT <317 secondi rispetto a quelli con OT ≥317 secondi (HR: 4.2; 95% CI: 2.6-6.8; P<0.001).
Take home message
I pazienti con riperfusione spontanea presentano tempi di occlusione trombotica più prolungati e di fibrinolisi endogena più rapidi, con un correlato clinico di infarti meno estesi e di miglior outcome.
Interpretazione dei dati
Il dato principale dello studio consiste nella dimostrata correlazione tra le caratteristiche del sistema coagulativo e fibrinolitico del pa-ziente e l’evoluzione dell’infarto miocardico di cui è affetto. Un lungo tempo di occlusione trombotica e una rapida risposta fibrinolitica si associano a una elevata probabilità di riperfusione spontanea (e quindi di infarti di modeste dimensioni con buona prognosi a distanza), mentre brevi tempi di occlusione trombotica e una risposta fibrinolitica lenta sono segnali negativi perché si accompagnano a una bassa probabilità di riperfusione, infarti di più ampie dimensioni e maggiori probabilità di eventi cardiovascolari a distanza. I dati non sono nuovi anche se ottenuti in una casistica molto ampia e con una metodologia non testata in precedenza in popolazioni STEMI. Dati della letteratura avevano già mostrato una correlazione della reattività piastrinica (misurata con Verify now) con la riperfusione spontanea [3]Capranzano P, Capodanno D, Bucciarelli-Ducci C, et al. Impact of residual platelet reactivity on reperfusion in patients with ST-segment elevation myocardial infarction undergoing primary … Continua a leggere. Così pure un sistema fibrinolitico efficiente e a rapida risposta si era dimostrato correlato con la prognosi nei pazienti dello studio PLATO indipendentemente dalla randomizzazione a ticagrelor o clopidogrel[4]Sumaya W, Wallentin L, James SK, et al. FibrinMclot properties independently predict adverse clinical outcome following acute coronary syndrome: a PLATO substudy. Eur Heart J. 2018;39:1078–1085.. Gli Autori sostengono che una forza dello studio consiste nella metodologia utilizzata, che si basa sull’effetto di uno shear stress elevato piuttosto che di un singolo agonista (ADP, trombossano), così che l’attivazione piastrinica risultante maggiormente si avvicina alle condizioni in vivo conseguenti alla presenza di una stenosi severa su cui si possa formare un trombo occlusivo. Questa osservazione potrebbe spiegare l’assenza di un effetto di ticagrelor sulla riperfusione pre-PCI nello studio ATLANTIC[5]Montalescot G, van ’t Hof AW, Lapostolle F, et al. Prehospital ticagrelor in ST-segment elevation myocardial infarction. N Engl J Med. 2014;371:1016–1027.. Una inibizione piastrinica più precoce e potente potrebbe invece facilitare una riperfusione spontanea. È quanto cercheranno di provare il trial SOS-AMI che sta studiando gli effetti di selatogrel (un potente inibitore del recettore P2Y12 a somministrazione sottocutanea) e lo studio CELEBRATE che utilizza invece zalunfiban (un inibitore della glicoproteina IIb/IIIa a somministrazione sottocutanea) per valutare l’efficacia di una potente inibizione piastrinica sul flusso coronarico pre-PCI in pazienti STEMI.
Editoriale: all’inseguimento dell’araba Fenice!
A cura di: Gianni Casella, UOC di Cardiologia, Ospedale Maggiore Bologna, Azienda USL di Bologna
La riperfusione spontanea, osservata in circa il 20% dei pazienti con infarto miocardico con sopraslivellamento del tratto ST (STEMI), si manifesta come un normale flusso epicardico (TIMI 3) nell’arteria correlata all’infarto, con o senza risoluzione del tratto ST, prima dell’angioplastica primaria (PPCI). Purtroppo, dopo decenni di ricerche i meccanismi che lo determinano in un particolare paziente e non in altri – a parità di condizioni cliniche – sono sconosciuti. In questo studio prospettico, svolto all’interno di un grande network per l’infarto Inglese, Kanji et al.[6]Kanji R, Gue YX, Memtsas V, Spencer NH, Gorog DA. Biomarkers of Thrombotic status predict spontaneous reperfusion in patients with ST-segment elevation myocardial infarction. J Am Coll Cardiol 2023; … Continua a leggere hanno cercato di correlare la riperfusione spontanea – definita come Flusso TIMI 3 – al profilo trombotico studiando il sangue intero prelevato a una serie consecutiva di pazienti con STEMI (n=801) prima della PPCI. Hanno quindi valutato in vitro, attraverso un sistema point-of-care, i tempi di occlusione (OT) e i tempi di lisi endogena (LT) e li hanno correlati con gli eventi cardiovascolari maggiori (morte, infarto miocardico o ictus) di questi pazienti. I risultati sono stati decisamente interessanti, perché gli Autori hanno notato che la riperfusione spontanea è associata a un OT più lungo (435 secondi vs 366 secondi; P<0,001) e a un LT più breve (1.257 secondi vs 1.616 secondi; P<0,001), a un valore di troponina più basso e a una migliore funzione ventricolare sinistra. LT era superiore a OT nel predire la riperfusione spontanea (area sotto la curva per LT: 0,707; IC 95%: 0,661-0,753; area sotto la curva per OT: 0,629; IC 95%: 0,581-0,677). Tra i pazienti con riperfusione spontanea, quelli che mostravano anche una risoluzione completa del tratto ST all’ECG – circa il 50% dei soggetti che avevano un flusso TIMI 3 pre-PPCI – hanno avuto un OT più lungo (P=0,002) e un LT più breve (P<0,001) rispetto a quelli con riperfusione parziale. La riperfusione spontanea non dipendeva dalle caratteristiche cliniche o al tempo intercorso tra l’insorgenza del dolore e la coronarografia. A 4 anni di distanza i pazienti con riperfusione spontanea hanno manifestato meno eventi cardiovascolari avversi maggiori rispetto a quelli senza (4,1% vs 10,6%; P=0,013). Questa differenza era più eclatante nei soggetti con riperfusione spontanea (Flusso TIMI 3) pre-PPCI e risoluzione completa del tratto ST (1,5% vs 10,1%; P=0,029). Kanji et. al. concludono che una ridotta reattività piastrinica e una fibrinolisi endogena più rapida, dimostrate rispettivamente da un tempo di occlusione più lungo e da un tempo di lisi più breve, correlano con minor danno miocardico e una migliore sopravvivenza. Attribuiscono, quindi un ruolo alla modulazione dello stato trombotico subito dopo l’insorgenza dello STEMI per facilitare la riperfusione spontanea e migliorare i risultati. Di nuovo, l’Araba Fenice si affaccia all’orizzonte del panorama dello STEMI! Ricordo che fin dagli anni novanta alle mie prime esperienze nella riperfusione con PPCI, si cercava di anticipare la riperfusione con trattamenti farmacologici – la cosiddetta angioplastica “facilitata” – perché era ben evidente che il vaso pervio all’arrivo in sala, correlava con un minor danno miocardico e una miglior prognosi. Ma come facilitare questa evenienza? Impedendo l’attivazione e l’aggregazione piastrinica da una parte, antagonizzando la generazione o l’attivazione della trombina dall’altra o ricorrendo alla fibrinolisi. Negli anni ho visto testare diversi trattamenti volti a contrastare la prima (ASA, antagonisti dei recettori piastrinici P2Y12 e antagonisti della glicoproteina IIb/IIIa), a colpire la generazione e l’attivazione della trombina (anticoagulanti parenterali) o a determinare una vera e propria fibrinolisi del trombo (farmaci fibrinolitici). Tanti entusiasmi – forse in realtà mode – di volta in volta spenti dalla pubblicazione dei risultati degli studi specifici. Eppure nessuno discute l’effetto positivo dell’ASA nello STEMI – abbiamo dati dagli anni ottanta – ma l’uso preospedaliero del farmaco è diventato pratica standard senza una dimostrazione che sia migliore della somministrazione in ospedale. Lo stesso per la doppia antiaggregazione, tanto determinante nella prevenzione della trombosi di stent e della riocclusione coronarica dopo angioplastica, quanto deludente quando l’abbiamo utilizzata in ambulanza, pre-PPCI per aumentare la probabilità di riperfusione spontanea nello studio ATLANTIC[7]Montalescot G, van ’t Hof AW, Lapostolle F, et al. Prehospital ticagrelor in ST-segment elevation myocardial infarction. N Engl J Med. 2014;371:1016–1027.. Qualche risultato più favorevole sulla riperfusione pre-PPCI l’abbiamo colto con gli antagonisti della glicoproteina IIb/IIIa per via endovenosa, ma a fronte di un netto incremento del rischio emorragico. Antagonizzare con anticoagulanti parenterali la generazione e l’attivazione della trombina pre-PPCI ha un forte razionale, perché riduce la generazione di fibrina e l’attivazione piastrinica secondaria, ma anche con questi farmaci i risultati sono stati modesti. La somministrazione di eparina in ambulanza, al momento del primo soccorso, è prassi comune, ma il suo impatto sulla riperfusione pre-PPCI è incerto. Non abbiamo visto dati convincenti in questo ambito nemmeno con la bivalirudina, mentre la fibrinolisi, pur con forti dati clinici a supporto, non ha retto il confronto con la PPCI quando quest’ultima è scesa in campo con network ben organizzati. Ora arriva lo studio di Kanji et al. a riportare in auge l’Araba Fenice della riperfusione pre-PPCI, ma questa volta studiando i pazienti che la presentano spontaneamente. L’osservazione che un individuo con una maggiore tendenza alla lisi spontanea del trombo e una minor reattività piastrinica abbia più probabilità di riperfusione spontanea in caso di STEMI è infatti stimolante. Fino ad oggi, abbiamo aggredito trombo e piastrine probabilmente con farmaci non sufficientemente specifici o talmente potenti da farci pagare il prezzo delle loro complicanze. Oggi è arrivato il momento di sviluppare o sperimentare altri prodotti che invece di attaccare direttamente il trombo, cerchino di modulare/potenziare fin dall’esordio dello STEMI i nostri meccanismi intrinseci che regolano lo stato trombotico portando alla soluzione della trombosi coronarica in un modo assai più fisiologico.
Bibliografia[+]
| ↑1 | Fefer P, Beigel R, Atar S, et al. Outcomes of patients presenting with clinical indices of spontaneous reperfusion in ST-elevation acute coronary syndrome undergoing deferred angiography. J Am Heart Assoc. 2017;6:e004552. |
|---|---|
| ↑2 | Genoud V, Lauricella AM, Kordich LC, Quintana I. Impact of homocysteine-thiolactone on plasma fibrin networks. J Thromb Thrombolysis. 2014;38:540–545. |
| ↑3 | Capranzano P, Capodanno D, Bucciarelli-Ducci C, et al. Impact of residual platelet reactivity on reperfusion in patients with ST-segment elevation myocardial infarction undergoing primary percutaneous coronary intervention. Eur Heart J Acute Cardiovasc Care 2016;5:475–486. |
| ↑4 | Sumaya W, Wallentin L, James SK, et al. FibrinMclot properties independently predict adverse clinical outcome following acute coronary syndrome: a PLATO substudy. Eur Heart J. 2018;39:1078–1085. |
| ↑5, ↑7 | Montalescot G, van ’t Hof AW, Lapostolle F, et al. Prehospital ticagrelor in ST-segment elevation myocardial infarction. N Engl J Med. 2014;371:1016–1027. |
| ↑6 | Kanji R, Gue YX, Memtsas V, Spencer NH, Gorog DA. Biomarkers of Thrombotic status predict spontaneous reperfusion in patients with ST-segment elevation myocardial infarction. J Am Coll Cardiol 2023; 811918-1932. |
Accedi per leggere tutto l'articolo
Inserisci i dati del tuo account su Cardiotalk per accedere e leggere tutto il contenuto dell'articolo.
Se non hai un account, clicca sul pulsante registrati e verrai reindirizzato al portale Cardiotalk per la registrazione.

