Inquadramento
I telomeri sono piccole porzioni di DNA che si trovano alla fine di ogni cromosoma hanno la funzione di impedire all’elica di sfibrarsi; essi si accorciano costantemente a ogni duplicazione, e quando raggiungono una lunghezza critica, le cellule entrano nella fase di senescenza: sono perciò un marker della capacità replicativa cellulare[1]Codd V, Wang Q, Allara E, et al. Polygenic basisand biomedical consequences of telomere length variation. Nat Genet. 2021;53(10):1425-1433. doi:10.1038/s41588-021-00944-6.. Studi di randomizzazione mendeliana hanno mostrato una relazione tra telomeri più corti ed evidenza di malattia coronarica, ma non vi sono dati sulla eventuale associazione con lo sviluppo di scompenso cardiaco.
Lo studio in esame
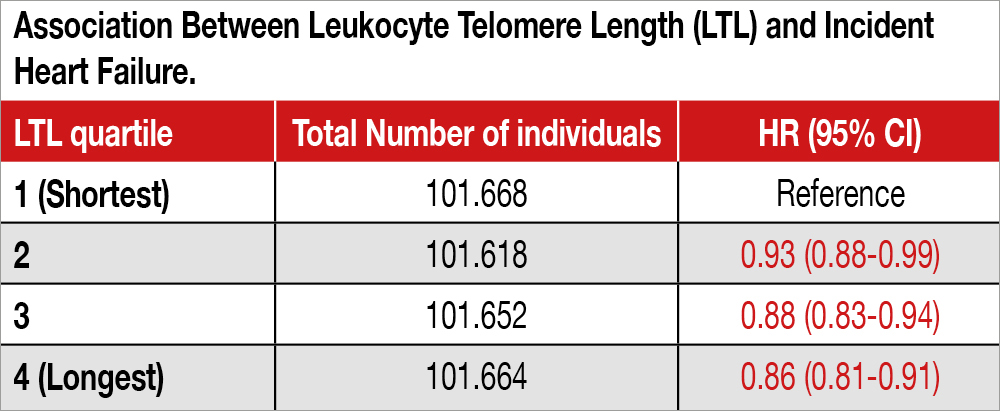
Studio trasversale di popolazione condotto in 40.459 individui, di età compresa tra 40 e 69 anni (età media 55 anni, 48% uomini), partecipanti all’UK Biobank (un database contenente informazioni cliniche, laboratoristiche e genetiche) che avevano aderito a uno studio di risonanza magnetica cardiaca (CMR), da cui sono stati derivati dati sulla struttura e funzione cardiaca utilizzando protocolli di intelligenza artificiale. La lunghezza dei telomeri dei leucociti (LTL) è stata misurata usando il metodo della reazione a catena della polimerasi quantitativa. I soggetti nel quartile più elevato di LTL erano più giovani e prevalentemente di sesso femminile con un profilo di rischio cardiovascolare più favorevole. Aggiustando per età, sesso, altezza e peso, LTL è risultata correlata con la massa del ventricolo sinistro (LVM), con i volumi ventricolari (LVV), con lo stroke volume del ventricolo sinistro (LVSV) e del ventricolo destro (RVSV) e con il volume dell’atrio sinistro. Episodi di scompenso cardiaco durante il periodo di follow-up sono stati meno frequenti nei soggetti con LTL nel quartile più alto (valutazione effettuata su tutti i 406.602 soggetti i cui dati sono stati inclusi in UK Biobank) come mostra la Tabella. All’analisi di randomizzazione mendeliana, sono state osservate associazioni tra LTL con LVM (P=.0001), con LVSV (P=.01) e con i volumi ventricolari (P=.01).
Take home message
In questo studio trasversale di popolazione, la lunghezza dei telomeri si è associata a cuori con volumi più elevati e funzione ventricolare migliore, caratteristiche che possono spiegare il minor rischio di scompenso nel follow-up.
Interpretazione dei dati
Gli Autori rilevano come le caratteristiche morfo-funzionali osservate nella popolazione studiata (associazione tra lunghezza dei telomeri con massa, volumi e gittata sistolica del ventricolo sinistro, replichino quanto osservato nell’adattamento fisiologico all’esercizio fisico del “cuore d’atleta” in cui si verifica un rimodellamento bilanciato e benefico della cavità ventricolare sinistra. L’analisi di randomizzazione mendeliana mostra come l’associazione tra questi parametri e la lunghezza dei telomeri suggerisca una potenziale relazione causale. Inoltre, tale associazione può rendere conto del minor rischio, per gli individui con telomeri più lunghi, di incorrere in episodi di scompenso cardiaco. Queste osservazioni confermano dati sperimentali che mostrano come, con l’invecchiamento, topi privi di telomerasi (“telomerase knockout mice”), l’enzima capace di allungare i telomeri a ogni replicazione, presentino un incremento dell’apoptosi dei cardiomiociti e maggiore propensione a sviluppare scompenso cardiaco[2]30. Leri A, Franco S, Zacheo A, et al. Ablation of telomerase and telomere loss leads to cardiacdilatation and heart failure associated with p53 upregulation. EMBO J. 2003;22(1):131-139. … Continua a leggere.
Editoriale: Nei telomeri è scritto il destino del nostro cuore?
Emilio Vanoli, Dipartimento di Scienze Infermieristiche, Università di Pavia; Eugenio Caradonna, Dipartimento di Patologia Clinica e Anatomia Patologica, Centro Diagnostico Italiano, Milano
Il telomero (TL) è la parte terminale del cromosoma e svolge una importante funzione protettiva della sua struttura riducendo il rischio di lesioni o di fusioni con cromosomi confinanti. La lunghezza del telomero (LTL) si riduce con le duplicazioni cellulari e descrive quindi la sua capacità funzionale e la sua storia[3]Cherif H, Tarry JL, Ozanne SE, Hales CN. Ageing and telomeres: a study into organ‐ and gender‐specific telomere shortening. Nucleic Acids Res. 2003;31(5):1576-1583. doi:10.1093/nar/gkg208.. La struttura del TL e la LTL sono elementi determinanti nell’invecchiamento, ma anche nell’insorgenza e progressione di molte patologie, comprese quelle cardiovascolari[4]Blasco MA. Telomeres and human disease: ageing, cancer and beyond. Nat Rev Genet. 2005;6(8):611-622. doi:10.1038/nrg1656. L’ipotesi di una esistente relazione tra LTL e rischio di malattia cardiovascolare e la sua evoluzione sfavorevole a scompenso cardiaco è sostenuta da numerose evidenze cliniche, nessuna delle quali è però definitiva per varie carenze dimensionali e non degli studi condotti fino a ora. Tuttavia, la LTL è correlata alla senescenza cellulare che è un noto fattore di rischio per le malattie cardiovascolari e non solo[5]Hu C, Zhang X, Teng T, Ma ZG, Tang QZ. Cellular Senescence in Cardiovascular Diseases: A Systematic Review. Aging Dis. 2022;13(1):103-128. doi:10.14336/ad.2021.0927.. In questo contesto lo studio di recente pubblicato su JAMA e generato dal UK Biobank database aggiunge una nuova solida base alle ipotesi sino a qui proposte. Lo UKB contiene dati genetici raccolti tra il 2006 e il 2010 su cui poi sono stati costruiti grandi studi prospettici per descrivere in modo assolutamente innovativo e sistematico i rapporti tra genotipo e fenotipo (in questo caso cardiovascolare) ed eventi a lungo termine. Da un database di 446.367 soggetti lo studio ha estratto ed esaminato i dati genetici e strumentali cardiaci di 40.459 soggetti (48.3% di genere maschile). Il fenotipo cardiaco è stato definito mediante Risonanza Magnetica Cardiaca, mentre le caratteristiche del TL sono state analizzate da leucociti circolanti. L’analisi dei dati, pesata per eventuali fattori confondenti quali età, genere e peso corporeo, ha dimostrato la presenza di una potenziale relazione causale tra LTL e parametri derivati dalla RMN cardiaca quali massa ventricolare sinistra, dimensione del VS e sua gettata sistolica: più lungo è il TL minore è il rischio di eventi cardiaci sfavorevoli ed evoluzione verso lo scompenso cardiaco. Infatti, è stata documentata la presenza di una relazione positiva tra LTL e massa del ventricolo sinistro (VS, β per 1-SD allungamento [LTL] = 0.47; 95% CI, 0.34-0.60; P= 4.0 x 10-12). Analogamente, un LTL più lungo è apparso associato con un maggiore volume del VS (β=1.33; 95% CI, 0.87- 1.79; P=1.8 x 10−8), e, nel complesso un VS più grande. La potenza statistica dei risultati si è mantenuta anche dopo correzione per la presenza di ipertensione arteriosa, diabete, dislipidemia e altri fattori di rischio noti per le malattie cardiovascolari. Un dato critico per impatto clinico sociale ed economico è l’evidenza di una relazione inversa tra LTL e rischio per lo sviluppo di scompenso cardiaco (HR.86 con 95% CI.81-.91, P=1.8x 10-6). Quest’ultimo dato appare solido perché basato sull’analisi di 7.827 casi di scompenso cardiaco in 10 anni di follow-up ottenuti sulla globalità dei soggetti afferenti allo UKB. La possibilità di implementare la definizione del rischio cardiovascolare mediante un’analisi morfologica del TL ottenibile dei leucociti circolanti è di sicuro di grande potenziale impatto clinico sociale ed economico. In particolare, la possibilità di valutare la LTL nella componente di cellule mononucleate che comprende le cellule staminali circolanti, può consentire di indicare lo stato di senescenza e le capacità rigenerative dell’organismo[6]Sahin E, DePinho RA. Linking functional decline of telomeres, mitochondria and stem cells during ageing. Nature. 2010;464(7288):520-528. doi:10.1038/nature08982.. La senescenza delle cellule staminali circolanti è correlata all’insorgenza delle patologie cardiovascolari e al decorso clinico[7]Hu C, Zhang X, Teng T, Ma ZG, Tang QZ. Cellular Senescence in Cardiovascular Diseases: A Systematic Review. Aging Dis. 2022;13(1):103-128. doi:10.14336/ad.2021.0927.. Queste evidenze cliniche hanno anche credibili basi sperimentali. In topi privati geneticamente della telomerasi (l’enzima che controlla l’integrità del TL) l’invecchiamento comporta una accelerazione dell’apoptosi miocitica e favorisce il rimodellamento negativo del VS. All’opposto, una stimolazione dell’espressione della telomerasi risulta un rimodellamento positivo del VS e un miglioramento della sopravvivenza. I partecipanti allo studio sono volontari, quasi tutti bianchi e culturalmente orientati verso un sano stile di vita. Questi potenziali bias di selezione non sono però tali da cancellare il valore dello studio anche se lasciano aperta la possibilità che le relazioni descritte tra LTL e rischio cardiovascolare possano essere diverse in differenti etnie. Questo studio consolida una via innovativa e basata su di un crescente numero di evidenze cliniche che potranno permettere, in modo relativamente semplice, di migliorare l’approccio di precisione alla gestione individuale del paziente cardiovascolare. L’accesso ai leucociti circolanti e alle cellule staminali circolanti (componente mononucleata dei leucociti) è di ovvia semplicità e applicabile a popolazioni di ampie dimensioni, mentre le tecnologie utilizzate sono note e destinate a essere progressivamente più fruibili con l’estensione del loro utilizzo. L’individuazione della LTL può trovare anche applicazione per la valutazione degli interventi terapeutici e di modifica dello stile di vita nell’ambito della prevenzione e terapia delle patologie cardiovascolari e non solo[8]Yeh JK, Wang CY. Telomeres and Telomerase in Cardiovascular Diseases. Genes. 2016;7(9):58. doi:10.3390/genes7090058.
Bibliografia[+]
| ↑1 | Codd V, Wang Q, Allara E, et al. Polygenic basisand biomedical consequences of telomere length variation. Nat Genet. 2021;53(10):1425-1433. doi:10.1038/s41588-021-00944-6. |
|---|---|
| ↑2 | 30. Leri A, Franco S, Zacheo A, et al. Ablation of telomerase and telomere loss leads to cardiacdilatation and heart failure associated with p53 upregulation. EMBO J. 2003;22(1):131-139. doi:10.1093/emboj/cdg013. |
| ↑3 | Cherif H, Tarry JL, Ozanne SE, Hales CN. Ageing and telomeres: a study into organ‐ and gender‐specific telomere shortening. Nucleic Acids Res. 2003;31(5):1576-1583. doi:10.1093/nar/gkg208. |
| ↑4 | Blasco MA. Telomeres and human disease: ageing, cancer and beyond. Nat Rev Genet. 2005;6(8):611-622. doi:10.1038/nrg1656 |
| ↑5, ↑7 | Hu C, Zhang X, Teng T, Ma ZG, Tang QZ. Cellular Senescence in Cardiovascular Diseases: A Systematic Review. Aging Dis. 2022;13(1):103-128. doi:10.14336/ad.2021.0927. |
| ↑6 | Sahin E, DePinho RA. Linking functional decline of telomeres, mitochondria and stem cells during ageing. Nature. 2010;464(7288):520-528. doi:10.1038/nature08982. |
| ↑8 | Yeh JK, Wang CY. Telomeres and Telomerase in Cardiovascular Diseases. Genes. 2016;7(9):58. doi:10.3390/genes7090058 |
Accedi per leggere tutto l'articolo
Inserisci i dati del tuo account su Cardiotalk per accedere e leggere tutto il contenuto dell'articolo.
Se non hai un account, clicca sul pulsante registrati e verrai reindirizzato al portale Cardiotalk per la registrazione.

