Stefano De Servi, Università degli Studi di Pavia
Inquadramento
Lo studio COAPT ha dimostrato un beneficio clinico dell’impianto di MitraClip (TEER) in pazienti scompensati con insufficienza mitralica funzionale (FMR) severa[1]Stone GW, Lindenfeld J, Abraham WT, et al. Transcatheter mitral-valve repair in patients with heart failure. N Engl J Med. 2018;379(24):2307–2318. https://doi.org/10.1056/NEJMoa1806640. Tuttavia, molti pazienti sono stati esclusi dallo studio sulla base di alcune caratteristiche cliniche e strumentali: shock cardiogeno, utilizzo e.v. di farmaci inotropi, utilizzo domiciliare di O2, FE <20%, ipertensione polmonare severa (>70 mmHg), aumento notevole del diametro telesistolico ventricolare sinistro (LVESD >7 cm), insufficienza tricuspidalica severa. Non ci sono informazioni sufficienti per indicare se anche queste tipologie di pazienti, con quadri di miocardiopatia molto avanzati, possano trarre anch’essi beneficio da tale procedura riparativa.
Lo studio in esame
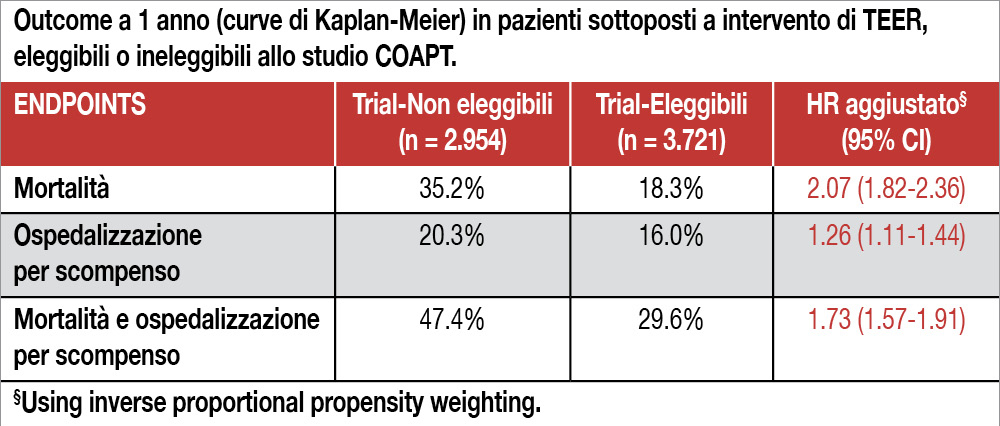
Sono state analizzate le procedure di TEER eseguite in pazienti con FMR, incluse nel registro della “Society of Thoracic Surgeons/American College of Cardiology Transcatheter Valve Therapy (STS/ACC TVT Registry)” ed effettuate tra il gennaio 2013 e l’aprile 2020. Su 6.675 procedure TEER, 2.954 (di cui 1.030 eseguite nel 2019/2020) erano state considerate noneleggibili per inserimento nello studio COAPT: il motivo principale era la presenza di insufficienza tricuspidalica severa (43%) seguita da uso di O2 domiciliare (31.1%), FE<20% (19.8%), shock cardiogeno (8.2%) e LVESD >70 mm (7.4%). La percentuale di pazienti non-eleggibili a COAPT rimaneva costante negli anni (circa 45%). Le caratteristiche cliniche erano sovrapponibili nei due gruppi (non-eleggibili versus eleggibili: età media 74.5 versus 73.4 anni, maschi 56.2% versus 58%, esiti infarto 40.5% versus 41.1%, esiti bypass aortocoronarico 30.1% versus 33.3%). I pazienti non-eleggibili avevano più frequentemente fibrillazione atriale (65.5% versus 58.1%), FE più bassa (35.2% versus 40%) I pazienti non eleggibili avevano un minor successo procedurale (definito come una insufficienza mitralica residua almeno moderata in assenza di mortalità, reintervento transcatetere o chirurgico) rispetto ai pazienti eleggibili (86.9% vs 92.6%; P<0.001) e un maggior numero (11.8% vs 5.7%; P<0.001) di complicanze (mortalità, bleeding maggiore, infarto miocardico, stroke, distacco parziale/embolizzazione/trombosi del device, intervento cardiochirurgico, complicanze vascolari maggiori). La mortalità ospedaliera (4.9% vs 0.9%; P<0.001), lo stroke (stroke (1.0% vs 0.3%; P<0.001) e gli interventi vascolari non pianificati (0.8% vs 0.3%; P=0.01) erano più frequenti nei pazienti non-eleggibili. Benchè un miglioramento clinico a 1 mese si sia verificato in un numero simile di pazienti ineleggibili ed eleggibili (78.9% e 77.0%), la mortalità a 1 anno è stata superiore nei pazienti “ineleggibili” così come i nuovi episodi di scompenso cardiaco (vedi Tabella). All’analisi multivariata, tutti i criteri di non-eleggibilità allo studio COAPT sono risultati significativamente associati all’endpoint mortalità/ospedalizzazione per scompenso a 1 anno, con il rischio maggiore per shock cardiogeno e necessità di supporto inotropo.
Take home message
Circa la metà dei pazienti con insufficienza mitralica funzionale trattati con impianto di Mitra-Clip non sarebbero stati eleggibili all’inserimento nello studio COAPT. Le incidenze di mortalità e scompenso a 1 anno sono risultate superiori rispetto ai pazienti eleggibili al trial.
Interpretazione dei dati
I dati rilevanti di questa analisi sono:
- circa la metà delle procedure di TEER eseguite negli Stati Uniti, anche recentemente, sono effettuate in pazienti che non avrebbero avuto i criteri di eleggibilità per essere arruolati nello studio COAPT;
- questi pazienti non-eleggibili hanno avuto una più alta mortalità sia ospedaliera che a 1 anno;
- ciascuna variabile causa di non-eleggibilità (shock cardiogeno, utilizzo e.v. di farmaci inotropi, utilizzo domiciliare di O2, FE <20%, aumento notevole del diametro telesistolico ventricolare sinistro, insufficienza tricuspidalica severa) è risultata significativamente associata all’endpoint mortalità e ospedalizzazione per scompenso a 1 anno.
Lo studio ha un notevole rilievo clinico, in quanto la popolazione di pazienti scompensati, per lo più anziani, con insufficienza mitralica funzionale, è in forte crescita e ci si domanda se l’intervento di TEER possa essere un’opzione terapeutica valida anche per i pazienti che presentino alcune caratteristiche clinico-strumentali che non li avrebbero resi eleggibili per l’inclusione nello studio COAPT, l’unico trial che sinora ha decretato l’efficacia della procedura di impianto di MitraClip e la sua superiorità rispetto a una terapia medica ottimale. È da osservare che questo studio non può rispondere alla domanda, perchè manca un gruppo di controllo in terapia medica ottimale. Semplicemente l’analisi mostra che questa popolazione di pazienti non-eleggibili a COAPT ha un alto rischio di mortalità e nuovi episodi di scompenso che richiedono l’ospedalizzazione, confermando peraltro osservazioni precedenti[2]Scotti A, Munafò A, Adamo M, et al. Transcatheter edge-to-edge repair in COAPT-ineligible patients: incidence and predictors of 2-year good outcome. Can J Cardiol. 2022;38:320–329.. Tuttavia, gli autori osservano arditamente che dai loro dati si può ipotizzare un beneficio di TEER anche nei pazienti non eleggibili a COAPT: infatti, nello studio COAPT[3]Stone GW, Lindenfeld J, Abraham WT, et al. Transcatheter mitral-valve repair in patients with heart failure. N Engl J Med. 2018;379(24):2307–2318. https://doi.org/10.1056/NEJMoa1806640 la riduzione di nuovi ricoveri per scompenso a 1 anno è stata ridotta del 50% nei pazienti trattati con MItraClip rispetto a quelli in terapia medica, mentre in questa analisi l’aumento di ospedalizzazioni per scompenso a 1 anno era superiore solo del 34% nei pazienti non-eleggibili rispetto agli eleggibili (mentre ci si sarebbe attesi un aumento del doppio). Tuttavia, è chiaro che solo uno studio randomizzato (TEER verso terapia medica ottimale) può risolvere il quesito clinico in questa popolazione a rischio molto elevato.
Editoriale: “Angioplastica imaging-guidata: è tempo per considerarla uno standard di trattamento nelle lesioni coronariche complesse?”
A cura di: Angela Buonpane, Francesco Fracassi, Enrico Romagnoli [Fondazione Policlinico Universitario Agostino Gemelli, IRCCS]
Negli ultimi anni abbiamo assistito a una progressiva presa di coscienza dei limiti dell’angiografia coronarica in termini sia diagnostici sia interventistici. In effetti, sebbene sia spesso la sola angiografia a guidare le scelte del cardiologo interventista, ne sono ormai ben documentati i limiti in termini di discrezionalità di interpretazione (i.e. natura bidimensionale dell’immagine) e di mancata caratterizzazione della placca coronarica. Di qui la necessità di una valutazione il più completa e oggettiva possibile ricercata nelle tecniche di imaging intravascolare. Numerosi sono gli studi[4]Zhang J, Gao X, Kan J, Ge Z, Han L, Lu S, et al. Intravascular Ultrasound Versus Angiography-Guided Drug-Eluting Stent Implantation: The ULTIMATE Trial. J Am Coll Cardiol. 2018 Dec … Continua a leggere che hanno testato l’impatto dell’ecografia intravascolare (IVUS) in primis e successivamente la tomografia a coerenza ottica (OCT), ai fini sia dell’interpretazione della malattia coronarica sia dell’ottimizzazione della rivascolarizzazione miocardica percutanea (PCI); studi che hanno portato le attuali linee guida della Società Europea di Cardiologia a raccomandarne l’utilizzo in casi selezionati (i.e. trattamento del tronco comune e delle restenosi intra-stent)[5] Neumann FJ, Sousa-Uva M, Ahlsson A, Alfonso F, Banning AP, Benedetto U, et al. 2018 ESC/EACTS Guidelines on myocardial revascularization. Vol. 40, European Heart Journal. Oxford University … Continua a leggere. Una recente metanalisi di G. W. Stone et al. Pubblicata sulla rivista “The Lancet”, che ha incluso 22 trial clinici per un totale di 15.964 pazienti, ha infatti evidenziato come l’angioplastica percutanea, guidata da metodiche di imaging intravascolare, riduca il rischio di morte, infarto del miocardio, rivascolarizzazione del vaso “target” e di trombosi di stent rispetto a una procedura guidata dalla sola angiografia[6]G.W. Stone EHCZAALNAAMYAULNRHolm. Intravascular imaging-guided coronary drug-eluting stent implantation: an updated network meta-analysis. The Lancet. 2024. In questo scenario, il trial “Optical Coherence Tomography–Guided or IntravascularUltrasound–Guided Percutaneous Coronary Intervention: The OCTIVUS Randomized Clinical Trial”[7] Kang DY, AJM, YSC, HSH, CYK, LCH, HSJ, LS, KSW, WH, OJH, CJC, HYJ, YYH, KH, CY, LJ, YYW, KSJ, BJH, DWPSJP. Optical Coherence Tomography-Guided or Intravascular Ultrasound-Guided … Continua a leggere ha il merito di aver confrontato, in uno studio randomizzato head to head, le due tecniche di imaging attualmente più utilizzate nella pratica clinica, l’OCT e l’IVUS appunto. Disegnato per dimostrare la non inferiorità dell’OCT rispetto all’IVUS, ha utilizzato come obiettivo primario composito l’incidenza di morte per cause cardiache, infarto del miocardio legato al vaso trattato o la necessità di una nuova rivascolarizzazione sullo stesso vaso a 1 anno di follow-up. Uno studio rilevante se si considera la numerosità della popolazione randomizzata (1.005 pazienti assegnati al gruppo OCT vs 1.003 pazienti assegnati al gruppo IVUS) e l’end-point clinico, risultato peraltro equivalente con le due metodiche. Recentemente, è stato pubblicato sul Journal of the American College of Cardiology un sottostudio dell’OCTIVUS trial che ha confrontato l’impatto delle due metodiche di imaging intravascolare nelle PCI delle lesioni coronariche complesse[8]Kang DY, Ahn JM, Yun SC, et al: Guiding intervention for Complex Coronary Lesions by Optical Coherence Tomography or Intravascular Ultrasound. J Am Coll Cardiol 2024; 83(3):401-413. … Continua a leggere. Dei 2.008 pazienti randomizzati nell’OCTIVUS trial, il 73,5% presentava lesioni classificabili come complesse intese come tronco comune non protetto, biforcazioni, lesioni ostiali, occlusioni totali croniche, lesioni severamente calcifiche o lunghe, restenosi intra-stent o malattia multivasale. Questo sottostudio ha di fatto confermato l’equivalenza procedurale e clinica dell’OCT rispetto all’IVUS a un follow-up di circa 2 anni, ma ha anche evidenziato alcune “piccole” differenze che potrebbero guidare la scelta di una metodica piuttosto che l’altra. In particolare, ha dimostrato come sebbene l’OCT, a differenza dell’IVUS, richieda la somministrazione aggiuntiva (e statisticamente maggiore) di mezzo di contrasto, questa non si traduca in un aumento del rischio di nefropatia da mezzo di contrasto per i pazienti. Allo stesso tempo, ha evidenziato come le due metodiche si equivalgano per la maggior parte delle lesioni studiate con l’eccezione delle restenosi intrastent e delle occlusioni croniche totali. La prima, statisticamente significativa, a favore dell’OCT sembrerebbe sottolineare il ruolo della maggiore risoluzione nell’interpretare ed, eventualmente, correggere le cause alla base della stent failure; la seconda, con un trend ampio ma non significativo a favore dell’IVUS, sottolineerebbe, invece, la sua maggiore utilità in contesti in cui una maggiore profondità di campo e la non necessità del mezzo di contrasto (i.e. falso lume) sono altamente raccomandabili. Più difficili da interpretare sono i risultati sul confronto tra OCT e IVUS relativi all’incidenza di complicanze procedurali (1.7% nel gruppo OCT vs 3.4% nel gruppo IVUS, P=0.03) e al successivo rischio di infarto miocardico relativo al vaso trattato (0.8% nel gruppo OCT vs 2.4% nel gruppo IVUS, P=0.03). Gli autori ipotizzano che il maggior tasso di complicanze osservate con l’IVUS potrebbe essere legato alle modalità di selezione del diametro dello stent, basato sul concetto media-to-media con l’IVUS e quindi più “aggressivo” rispetto all’approccio basato sul lume comunemente utilizzato con l’OCT. Resta però il fatto che l’approccio media tomedia è stato ampiamente documentato come sicuro e utilizzato anche per l’OCT nei più recenti trial clinici[9]Ali ZA, Landmesser U, Maehara A, Matsumura M, Shlofmitz RA, Guagliumi G, et al. Optical Coherence Tomography– Guided versus Angiography-Guided PCI. New England Journal of Medicine … Continua a leggere. Invece è possibile che entrambe le differenze siano legate alle maggiori capacità di analisi dell’OCT rispetto all’IVUS in termini di identificazione delle placche vulnerabili e di riduzione del “geographic miss”; due elementi che hanno sicuramente giocato un ruolo nelle scelte degli operatori che avevano un ampio margine di interpretazione e d’azione durante le procedure. Purtroppo, la caratterizzazione della composizione di placca non era prevista nel contesto di quello che è stato definito dagli stessi autori come uno studio pragmatico sull’utilizzo dell’imaging intravascolare. Ultimo spunto di riflessione, relativo ai risultati di questo studio, è il fatto che l’obiettivo prefissato in termini di espansione dello stent (>80%) in entrambi i gruppi sia stato raggiunto in meno della metà dei casi. È un dato in linea con gli studi precedenti, che sottolinea come l’espansione dello stent non debba essere l’obiettivo primario dell’impiego dell’imaging intravascolare. Specie nel contesto delle angioplastiche più complesse, l’utilizzo dell’imaging intravascolare trova, infatti, ampia ragione nell’identificazione delle placche da trattare (es. vulnerabili), nella scelta delle strategie di trattamento della lesione (es. debulking) e solo infine nella verifica dell’efficacia finale della procedura (es. espansione dello stent); efficacia per la quale a oggi non esiste un consenso in termini di malapposizione, ipoespansione o dissezione residua[10]Truesdell AG, Alasnag MA, Kaul P, Rab ST, Riley RF, Young MN, et al. Intravascular Imaging During Percutaneous Coronary Intervention: JACC State-of-the-Art Review. Vol. 81, Journal of the … Continua a leggere. In conclusione, questo sottostudio del trial OCTIVUS conferma la sicurezza oltre che l’efficacia di entrambe le tecniche di imaging anche negli scenari coronarici più complessi con un tasso di eventi avversi registrato a 2 anni inferiore rispetto a quanto inizialmente ipotizzato nel disegno dello studio[11]Kang DY, AJM, YSC, HSH, CYK, LCH, HSJ, LS, KSW, WH, OJH, CJC, HYJ, YYH, KH, CY, LJ, YYW, KSJ, BJH, DWPSJP. Optical Coherence Tomography-Guided or Intravascular Ultrasound-Guided Percutaneous … Continua a leggere. Sebbene i risultati a oggi disponibili sull’impiego dell’imaging intravascolare siano incoraggianti, molta strada rimane ancora da fare per far sì che il suo utilizzo diventi parte integrante dei protocolli diagnostici e terapeutici nei pazienti con lesioni coronariche complesse.
Bibliografia[+]
| ↑1, ↑3 | Stone GW, Lindenfeld J, Abraham WT, et al. Transcatheter mitral-valve repair in patients with heart failure. N Engl J Med. 2018;379(24):2307–2318. https://doi.org/10.1056/NEJMoa1806640 |
|---|---|
| ↑2 | Scotti A, Munafò A, Adamo M, et al. Transcatheter edge-to-edge repair in COAPT-ineligible patients: incidence and predictors of 2-year good outcome. Can J Cardiol. 2022;38:320–329. |
| ↑4 | Zhang J, Gao X, Kan J, Ge Z, Han L, Lu S, et al. Intravascular Ultrasound Versus Angiography-Guided Drug-Eluting Stent Implantation: The ULTIMATE Trial. J Am Coll Cardiol. 2018 Dec 18;72(24):3126–37.; Lee JM, Choi KH, Song Y Bin, Lee JY, Lee SJ, Lee SY, et al. Intravascular Imaging–Guided or Angiography-Guided Complex PCI. New England Journal of Medicine. 2023 May 4;388(18):1668–79. |
| ↑5 | Neumann FJ, Sousa-Uva M, Ahlsson A, Alfonso F, Banning AP, Benedetto U, et al. 2018 ESC/EACTS Guidelines on myocardial revascularization. Vol. 40, European Heart Journal. Oxford University Press; 2019. p. 87–165. |
| ↑6 | G.W. Stone EHCZAALNAAMYAULNRHolm. Intravascular imaging-guided coronary drug-eluting stent implantation: an updated network meta-analysis. The Lancet. 2024 |
| ↑7 | Kang DY, AJM, YSC, HSH, CYK, LCH, HSJ, LS, KSW, WH, OJH, CJC, HYJ, YYH, KH, CY, LJ, YYW, KSJ, BJH, DWPSJP. Optical Coherence Tomography-Guided or Intravascular Ultrasound-Guided Percutaneous Coronary Intervention: The OCTIVUS Randomized Clinical Trial. Circulation. 2023. |
| ↑8 | Kang DY, Ahn JM, Yun SC, et al: Guiding intervention for Complex Coronary Lesions by Optical Coherence Tomography or Intravascular Ultrasound. J Am Coll Cardiol 2024; 83(3):401-413. doi:10.1016/j.jacc.2023.10.017 |
| ↑9 | Ali ZA, Landmesser U, Maehara A, Matsumura M, Shlofmitz RA, Guagliumi G, et al. Optical Coherence Tomography– Guided versus Angiography-Guided PCI. New England Journal of Medicine [Internet]. 2023 Aug 26;389(16):1466–76.Available from: https://doi.org/10.1056/NEJMoa2305861. |
| ↑10 | Truesdell AG, Alasnag MA, Kaul P, Rab ST, Riley RF, Young MN, et al. Intravascular Imaging During Percutaneous Coronary Intervention: JACC State-of-the-Art Review. Vol. 81, Journal of the American College of Cardiology. Elsevier Inc.; 2023. p. 590–605. |
| ↑11 | Kang DY, AJM, YSC, HSH, CYK, LCH, HSJ, LS, KSW, WH, OJH, CJC, HYJ, YYH, KH, CY, LJ, YYW, KSJ, BJH, DWPSJP. Optical Coherence Tomography-Guided or Intravascular Ultrasound-Guided Percutaneous Coronary Intervention: The OCTIVUS Randomized Clinical Trial. Circulation. 2023 |
Accedi per leggere tutto l'articolo
Inserisci i dati del tuo account su Cardiotalk per accedere e leggere tutto il contenuto dell'articolo.
Se non hai un account, clicca sul pulsante registrati e verrai reindirizzato al portale Cardiotalk per la registrazione.

