Inquadramento
Tra gli effetti benefici degli inbitori SGLT2 nei pazienti con scompenso cardiaco vi è un aumento dell’emoglobina, che permette di correggere una condizione di anemia[1]Aberle J, Menzen M, Schmid SM, et al. Dapagliflozin effects on haematocrit, red blood cell count and reticulocytes in insulin-treated patients with type 2 diabetes. Sci Rep. 2020;10:22396. … Continua a leggere. Questa azione benefica è mediata da un aumento di eritropoietina e una riduzione di epcidina e ferritina, con il risultato di mobilizzare il ferro immagazzinato nel sistema reticolo endoteliale e nei macrofagi. Tale effetto potrebbe essere causato da un meccanismo anti-infiammatorio, oppure da una azione dell’eritropoietina sull’eritroferrone, una molecola prodotta dagli eritroblasti, che riduce la produzione epatica di epcidina[2]Arezes J, Foy N, McHugh K, et al. Erythroferrone inhibits the induction of hepcidin by BMP6. Blood. 2018;132:1473–1477.
Lo studio in esame
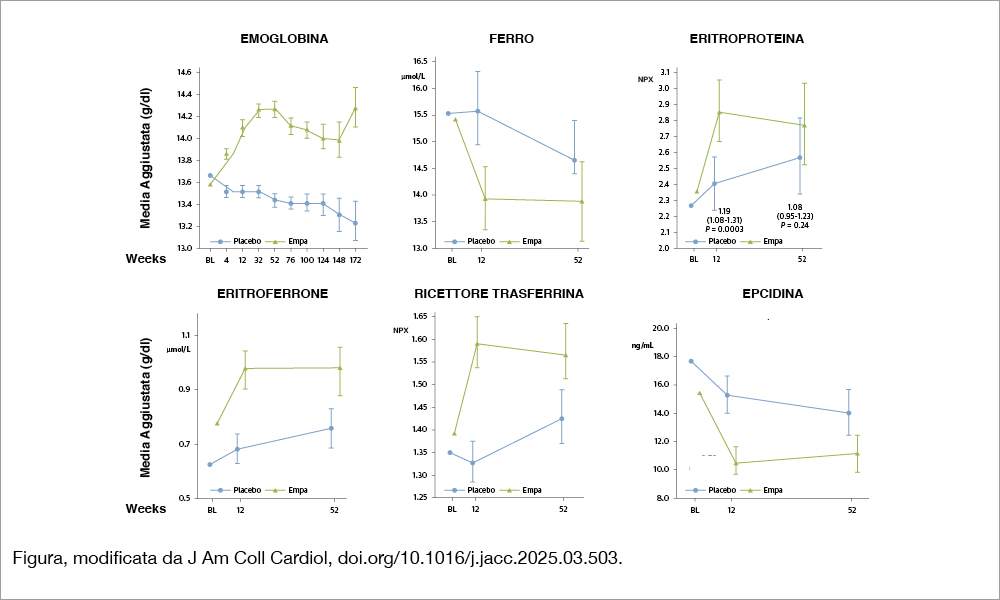
Gli Autori hanno misurato i biomarker relativi al metabolismo del ferro al basale e a 12 e 52 settimane in 1.139 pazienti trattati con placebo o empagliflozin negli studi EMPEROR (EMPagliflozin outcomE tRial in Patients With chrOnic heaRt Failure) Reduced[3]Packer M, Anker SD, Butler J, et al. Cardiovascular and renal outcomes with empagliflozin in heart failure. N Engl J Med. 2020;383:1413–1424. ed EMPEROR Preserved[4]Anker SD, Butler J, Filippatos G, et al. Empagliflozin in heart failure with a preserved ejection fraction. N Engl J Med. 2021;385:1451–1461. correlandoli allo stato clinico e agli effetti di empaglifozin sull’evoluzione dello scompenso. I biomarker misurati erano le concentrazioni seriche di ferro, trasferrina, ferritina, sideremia e quelle plasmatiche di epcidina, eritroferrone, recettore della trasferrina, eritropoietina e interleuchina-6. I livelli di eritropoietina, eritroferrone e recettore della trasferrina aumentavano in corrispondenza della severità del grado di scompenso (valutato in base a classe NYHA e valori di NTproBNP) mentre epcidina e ferritina non risultavano correlate. Rispetto al placebo, empagliflozin aumentava l’emoglobina di 0.6 – 0.9 g/dL (P<0.001, vedi Figura), con una minore efficacia nei pazienti con valori più alti del recettore della trasferrina e i valori più bassi di epcidina, mentre gli altri biomarker non influenzavano la risposta eritrocitica al farmaco. Vi era una correlazione significativa tra eritropoietina ed eritroferrone, sia in basale (rho=0.56) che a 12 settimane e tra le variazioni di eritropoietina ed eritroferrone a 12 settimane, sia nei pazienti in empagliflozin (rho = 0.50) che in placebo (rho = 0.52). Si osservavano correlazioni più modeste tra eritroferrone ed epcidina in basale (rho = –0.31) che tra le loro rispettive variazioni a 12 settimane sia in empaglifozin (rho = –0.30) che nel gruppo placebo (rho = –0.32) e tra eritropoietina e recettore della trasferrina in basale (rho=0.41) e tra le rispettive variazioni a 12 settimane (placebo rho=0.35, empaglifozin rho = 0.38). La ferritina si correlava al basale con l’epcidina (rho = 0.77), ma le rispettive variazioni a 12 settimane erano correlate nel gruppo empaglifozin (rho = 0.51) ma non nel gruppo placebo.
Take home message
L’asse eritropoietina-eritroferrone-epcidina è progressivamente attivato nei pazienti scompensati con l’avanzare della malattia, particolarmente in quelli in trattamento con empaglifozin in parallelo con l’effetto farmacologico di aumento dell’eritropoiesi e di mobilizzazione del ferro dai depositi. Queste variazioni sono importanti per comprendere il meccanismo d’azione degli inibitori SGLT2 e per monitorare la risposta al trattamento.
Interpretazione dei dati
L’ipossia renale determina la sintesi di eritropoietina che a sua volta stimola il midollo osseo alla produzione delle cellule della serie eritrocitaria e promuove la sintesi di eritroferrone che, sopprimendo la produzione epatica di epcidina, induce la mobilizzazione del ferro dai depositi del sistema reticolo-endoteliale e il suo assorbimento a livello gastrointestinale. I dati di questo studio mostrano infatti una correlazione tra i livelli di eritropoietina ed eritroferrone, mentre l’attesa correlazione inversa con i livelli di epcidina è molto modesta, suggerendo che la riduzione di epcidina, presente sia nel gruppo placebo che nel gruppo empaglifozin (come mostra la Figura), sia influenzata da ulteriori fattori, in particolare da citochine infiammatorie. Infatti, l’infiammazione induce un aumento sia di ferritina che di epcidina[5]Nemeth E, Valore EV, Territo M, Schiller G, Lichtenstein A, Ganz T. Hepcidin, a putative mediator of anemia of inflammation, is a type II acute-phase protein. Blood. 2003;101:2461–2463, contrastando l’azione dell’eritroferrone. L’attivazione dell’asse eritropoietina – eritroferrone – epcidina è progressiva al peggioramento dello scompenso, in relazione alla concomitante riduzione del flusso renale, e si associa a un outcome sfavorevole. Tale attivazione è più accentuata nei pazienti trattati con empaglifozin e si traduce in livelli più elevati, rispetto al placebo, di eritropoietina (+ 20%), eritroferrone (+ 40%) e ridotti valori di epcidina (- 20%). In tal modo il farmaco determina un aumento di emoglobina, come mostra la Figura. È stato ipotizzato che l’incremento di eritropoietina, indotto dagli inibitori SGLT2, avvenga a livello epatico e non sia secondario a una maggiore ipossia renale. La maggiore soppressione di epcidina e ferritina nei pazienti trattati con empaglifozin dipende dalla sua azione anti-infiammatoria che permette di abbassarne i valori, inducendo una mobilizzazione di ferro dai depositi macrofagici e intracellulari, così da determinare eritrocitosi anche in assenza di concomitante terapia marziale[6]Packer M. How can sodium-glucose cotransporter 2 inhibitors stimulate erythrocytosis in patients who are iron-deficient? Implications for understanding iron homeostasis in heart failure. Eur J Heart … Continua a leggere. Va anche osservato che un’azione collaterale benefica dell’inibizione di SGLT2 è rappresentata da un aumento dei depositi miocardici di ferro, una condizione che si associa a un miglioramento della funzione cardiaca e a un rimodellamento ventricolare inverso[7]Angermann CE, Santos-Gallego CG, Requena-Ibanez JA, et al. Empagliflozin effects on iron metabolism as a possible mechanism for improved clinical outcomes in non-diabetic patients with systolic heart … Continua a leggere.
Bibliografia[+]
| ↑1 | Aberle J, Menzen M, Schmid SM, et al. Dapagliflozin effects on haematocrit, red blood cell count and reticulocytes in insulin-treated patients with type 2 diabetes. Sci Rep. 2020;10:22396. https://doi.org/10.1038/s41598-020-78734. |
|---|---|
| ↑2 | Arezes J, Foy N, McHugh K, et al. Erythroferrone inhibits the induction of hepcidin by BMP6. Blood. 2018;132:1473–1477 |
| ↑3 | Packer M, Anker SD, Butler J, et al. Cardiovascular and renal outcomes with empagliflozin in heart failure. N Engl J Med. 2020;383:1413–1424. |
| ↑4 | Anker SD, Butler J, Filippatos G, et al. Empagliflozin in heart failure with a preserved ejection fraction. N Engl J Med. 2021;385:1451–1461. |
| ↑5 | Nemeth E, Valore EV, Territo M, Schiller G, Lichtenstein A, Ganz T. Hepcidin, a putative mediator of anemia of inflammation, is a type II acute-phase protein. Blood. 2003;101:2461–2463 |
| ↑6 | Packer M. How can sodium-glucose cotransporter 2 inhibitors stimulate erythrocytosis in patients who are iron-deficient? Implications for understanding iron homeostasis in heart failure. Eur J Heart Fail. 2022;24:2287–2296. |
| ↑7 | Angermann CE, Santos-Gallego CG, Requena-Ibanez JA, et al. Empagliflozin effects on iron metabolism as a possible mechanism for improved clinical outcomes in non-diabetic patients with systolic heart failure. Nat Cardiovasc Res.
2023;2:1032–1043. |
Accedi per leggere tutto l'articolo
Inserisci i dati del tuo account su Cardiotalk per accedere e leggere tutto il contenuto dell'articolo.
Se non hai un account, clicca sul pulsante registrati e verrai reindirizzato al portale Cardiotalk per la registrazione.

