Inquadramento
I pazienti con storia di stroke o ischemia cerebrale sono ad alto rischio di un nuovo evento ictale. Negli studi individuali di confronto tra antagonisti della vitamina K e anticoagulanti orali diretti, in pazienti con fibrillazione atriale (AF) non è possibile disegnare con precisione la storia clinica dei pazienti che subiscono uno stroke nonostante la terapia anticoagulante, perché questi eventi sono poco numerosi. È stata perciò intrapresa una collaborazione tra gli autori dei quattro studi di confronto con lo scopo di creare un database comune (COMBINE AF), che permettesse di valutare il decorso clinico dei pazienti che dopo la randomizzazione sono risultati affetti da stroke[1]Connolly SJ, Ezekowitz MD, Yusuf S, Eikelboom J, Oldgren J, Parekh A, et al. Dabigatran versus warfarin in patients with atrial fibrillation. N Engl J Med 2009;361:1139–1151. … Continua a leggere[2]Patel MR, Mahaffey KW, Garg J, Pan G, Singer DE, Hacke W, et al. Rivaroxaban versus warfarin in nonvalvular atrial fibrillation. N Engl J Med 2011;365:883–891. https://doi. … Continua a leggere[3]Granger CB, Alexander JH, McMurray JJ, Lopes RD, Hylek EM, Hanna M, et al. Apixaban versus warfarin in patients with atrial fibrillation. N Engl J Med 2011;365:981–992. … Continua a leggere[4]Giugliano RP, Ruff CT, Braunwald E, Murphy SA, Wiviott SD, Halperin JL, et al. Edoxaban versus warfarin in patients with atrial fibrillation. N Engl J Med 2013;369: 2093–2104. … Continua a leggere.
Lo studio in esame
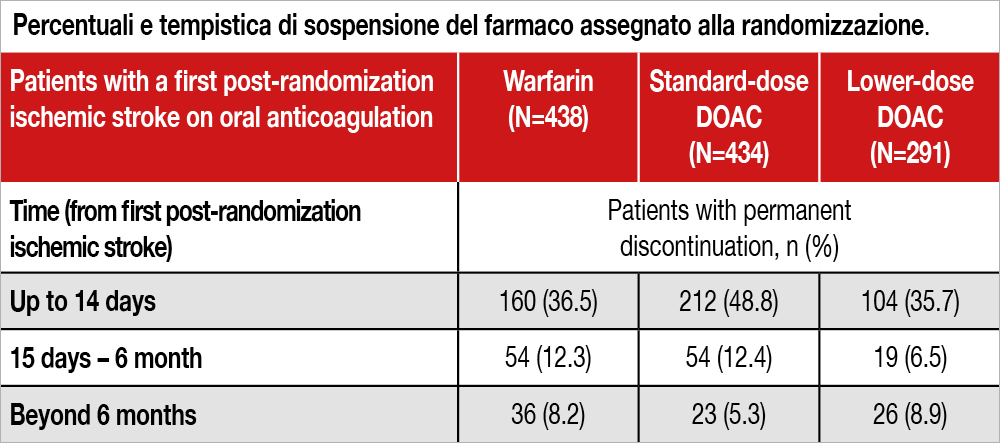
Sono stati inclusi 1.163 pazienti (438 con warfarin, 434 con DOAC dose piena, 291 con DOAC a dose ridotta) che hanno avuto uno stroke durante lo svolgimento dei quattro trial di confronto, e che sono stati seguiti per una mediana di 337 giorni dopo l’evento. L’età mediana era di 73 anni, 39% erano donne, 35% con storia di stroke prima dell’arruolamento, 46.6% con storia di scompenso cardiaco, mediana CHA2DS2-VASc score 4. I pazienti che non avevano avuto stroke durante lo studio avevano un’età mediana di 72 anni, 37.2% erano donne, 17.7% con storia di stroke prima dell’arruolamento, 46.1% con storia di scompenso cardiaco, mediana CHA2DS2-VASc score 4. Un nuovo stroke si è verificato in 74 pazienti con una incidenza cumulativa a 1 anno del 7% (10.3% a due anni) e una mortalità a 3 mesi del 12.4% (18.1% a 1 anno e 25.0% a 2 anni). Da un terzo a poco meno della metà dei pazienti aveva sospeso il farmaco assegnato alla randomizzazione (vedi Tabella), e non è noto come fossero stati trattati successivamente. Una “landmark analysis” (che includeva solo i 640 pazienti che dopo 15 giorni dall’episodio di stroke avevano continuato l’anticoagulante assegnato alla randomizzazione) mostrava dati sovrapponibili a quelli della casistica globale (incidenza di stroke ricorrente 6.8% a 1 anno). I pazienti con stroke pregresso avevano un rischio più elevato di nuovo stroke a 1 anno rispetto ai pazienti che non presentavano questa anamnesi (10.4% versus 5.1%).
Take home message
I pazienti con AF, che subiscono uno stroke in terapia anticoagulante, sono a maggior rischio di un ulteriore episodio di stroke e di mortalità rispetto a coloro che non lo presentano. In questa popolazione sono necessarie nuove strategie terapeutiche da testare con appropriati studi randomizzati.
Interpretazione dei dati
I dati di questa analisi mostrano che la recidiva di stroke nei pazienti che assumono anticoagulanti è piuttosto alta, con una incidenza di eventi che si concentra soprattutto nel primo anno successivo all’evento indice. Interessante notare come l’incidenza di stroke ricorrente si abbassa dal 7% al 5.5% a 1 anno, se si escludono i pazienti trattati con dose ridotta di DOAC. Infatti, nello studio RE-LY vi è stato un 11% di rischio di stroke in più utilizzando 110 mg anziché 150 mg e nello studio ENGAGE-AF un rischio significativo del 41%, utilizzando una dose di 30 mg, anziché 60 mg di edoxaban. La mortalità dopo uno stroke è stata piuttosto alta (12.4% a 3 mesi e 18.1% a 1 anno), eccedendo di 2.7–4.9 per 100 pazienti/anno la mortalità globale osservata nei vari trial e di 3.2–5.2 per 100 pazienti/anno quella dei pazienti arruolati nei trial con anamnesi positiva per stroke. Ci sono ancora molte incertezze nel trattamento dei pazienti che subiscono uno stroke mentre sono in terapia anticoagulante: non è chiaro se ci debba essere uno “switch” nell’uso dei farmaci anticoagulanti, mentre i pareri sembrano concordanti nel reintrodurre tale terapia entro le prime due settimane dall’evento[5]Klijn CJ, Paciaroni M, Berge E, Korompoki E, Kõrv J, Lal A, et al. Antithrombotic treatment for secondary prevention of stroke and other thromboembolic events in patients with stroke or transient … Continua a leggere. Un aspetto che dovrà essere chiarito da nuovi trial randomizzati è se la chiusura percutanea dell’auricola, in aggiunta alla terapia anticoagulante, possa essere di giovamento in questi pazienti, mentre non è confermata da studi recenti (per eccesso di sanguinamenti e di mortalità) la strategia di aggiungere un farmaco antiaggregante all’anticoagulante[6]Yasuda S, Kaikita K, Akao M, Ako J, Matoba T, Nakamura M, et al. Antithrombotic therapy for atrial fibrillation with stable coronary disease. N Engl J Med 2019;381: 1103–1113. … Continua a leggere.
Editoriale: “Come trattare un paziente con ictus in terapia anticoagulante? Più dubbi che certezze”
A cura di: Ginevra Annoni e Roberto Rordorf, Unità di Aritmologia ed Elettrofisiologia, IRCCS Policlinico San Matteo, Dipartimento di Medicina Molecolare, Università di Pavia
“Outcomes of patients with atrial fibrillation and ischemic stroke while on oral anticoagulation” è un’analisi di 5 studi randomizzati (RE-LY, AVERROES, ROCKET AF, ARISTOTLE ed ENGAGE-AF TIMI 48) che si è posta l’obiettivo di valutare l’outcome, in termini di ricorrenza di stroke (outcome primario) e di mortalità, in pazienti affetti da fibrillazione atriale con un evento cerebrale ischemico, nonostante la terapia anticoagulante con nuovi anticoagulanti orali (NOAC), NOAC a dosaggio ridotto o inibitori della vitamina K (VKA). Dei 74.491 pazienti arruolati negli studi, 1.163 (1.6%) hanno avuto un evento post-randomizzazione durante terapia anticoagulante e sono stati inclusi nell’analisi; il follow-up è durato in media 337 giorni dall’evento indice. Si è manifestato un secondo evento ischemico in 74 pazienti (6.4%), con un’incidenza sovrapponibile nel gruppo randomizzato a NOAC rispetto a VKA; dall’analisi dei dati, l’incidenza cumulativa di ictus ricorrente è risultata del 7% e del 10.3% rispettivamente a 1 e 2 anni. Tali dati sono stati confermati anche nelle due “sensitivity analyses” per l’outcome primario condotte successivamente: la prima ha escluso i 14 giorni successivi al primo evento cerebrale e ha preso in considerazione solamente pazienti vivi, a rischio di un secondo evento e che non avevano interrotto la terapia anticoagulante nelle prime due settimane dopo l’evento indice. La seconda ha escluso i pazienti randomizzati a dosaggio ridotto di NOAC. La mortalità nei pazienti con ictus, nonostante terapia anticoagulante orale, è risultata del 12.4% a 3 mesi e del 18% a 1 anno, significativamente maggiore rispetto ai pazienti che non hanno avuto eventi. È oramai noto che la terapia anticoagulante orale riduca ma non annulli il rischio di ictus ischemico nei pazienti affetti da fibrillazione atriale, con un rischio residuo dell’1-2%/anno, che è circa doppio nei pazienti con storia di pregresso evento ischemico cerebrale[7]Robert G. Hart, Lesly A. Pearce, Maria I. Aguilar. Meta-analysis: Antithrombotic Therapy to Prevent Stroke in Patients Who Have Nonvalvular Atrial Fibrillation. Ann Intern Med.2007;146:857-867. … Continua a leggere. Per tale ragione, nello score CHADsVASc, lo stroke/TIA pregresso, insieme all’età maggiore di 75 anni, hanno il peso maggiore. Tuttavia, gli studi fino ad ora disponibili, non hanno stimato gli outcome e il rischio di ricorrenza di ictus ischemico nei pazienti con pregresso evento in corso di terapia anticoagulante che, come evidente invece dai risultati dello studio COMBINE-AF, costituiscono una popolazione ad alto rischio, che necessita una particolare attenzione. Ad oggi, inoltre, non esistono indicazioni terapeutiche codificate per questa categoria di pazienti che vengono trattati in maniera molto eterogenea in attesa di maggiori evidenze scientifiche. Alcuni centri eseguono un cambio ad un anticoagulante in duplice somministrazione giornaliera, ove possibile, in considerazione della emivita media di circa 11-17h di tutti i NOAC, per favorire una maggiore efficacia antitrombotica. Tuttavia, non vi sono ancora dati riguardanti l’efficacia di un passaggio da un anticoagulante a un altro a seguito di un evento[8]Jan Steffel, Ronan Collins, Matthias Antz, Pieter Cornu, Lien Desteghe, Karl Georg Haeusler, Jonas Oldgren, Holger Reinecke, Vanessa Roldan-Schilling, Nigel Rowell, Peter Sinnaeve, Thomas Vanassche, … Continua a leggere. Inoltre, non vi sono ancora indicazioni riguardo le tempistiche di ripresa della terapia anticoagulante dopo un evento cerebrale ischemico, periodo in cui si deve bilanciare il rischio emorragico con quello di recidiva ischemica: tuttavia, sono in corso e già conclusi, diversi trial randomizzati[9]Oldgren J, Åsberg S, Hijazi Z, Wester P, Bertilsson M, Norrving B; National TIMING Collaborators. Early Versus Delayed Non-Vitamin K Antagonist Oral Anticoagulant Therapy After Acute Ischemic Stroke … Continua a leggere[10]Best JG, Arram L, Ahmed N, Balogun M, Bennett K, Bordea E, Campos MG, Caverly E, Chau M, Cohen H, Dehbi HM, Doré CJ, Engelter ST, Fenner R, Freemantle N, Hunter R, James M, Lip GY, Murray ML, … Continua a leggere che dimostrano che la reintroduzione precoce (entro 4 giorni) del NAO a seguito di un evento, sia superiore in termini di riduzione del rischio di recidiva rispetto alla reintroduzione più tardiva (dai 5 ai 14 giorni), a parità di sicurezza in termini di complicanze emorragiche. Infine, l’aggiunta di una terapia antiaggregante alla terapia anticoagulante non è risultata efficace nel ridurre il rischio di ricorrenza di ictus e, al contrario, in diversi trial randomizzati, ha dimostrato un paradossale aumento degli eventi cerebrali, ischemici e non[11]Alexander P Benz, Isabelle Johansson, Willem J M Dewilde, Renato D Lopes, Roxana Mehran, Samantha Sartori, Nikolaus Sarafoff, Satoshi Yasuda, William F, McIntyre, Jeff S Healey, Ashkan Shoamanesh, … Continua a leggere[12]Yasuda S, Kaikita K, Akao M, Ako J, Matoba T, Nakamura M, Miyauchi K, Hagiwara N, Kimura K, Hirayama A, Matsui K, Ogawa H; AFIRE Investigators. Antithrombotic Therapy for Atrial Fibrillation with … Continua a leggere. Recentemente, lo studio LAOS III ha dimostrato che la chiusura chirurgica dell’auricola di sinistra, in aggiunta alla terapia anticoagulante, ha ridotto l’endpoint composito di ictus ischemico ed embolia sistemica del 33% nei pazienti con fibrillazione atriale sottoposti a intervento cardiochirurgico[13]Withlock RP, Belley-Cote EP, Paparella D, Healey JS, Brady K, Sharma M, et al. Left atrial appendage occlusion during cardiac surgery to prevent stroke. N Engl J Med 2021; 384: 2081-2091. … Continua a leggere. Tale studio ha suggerito l’ipotesi che la chiusura percutanea dell’auricola, la cui sicurezza ed efficacia è ben dimostrata[14]Turagam MK, Osmancik P, Neuzil P, Dukkipati SR, Reddy VY. Left Atrial Appendage Closure Versus Oral Anticoagulants in Atrial Fibrillation: A Meta-Analysis of Randomized Trials. J Am Coll Cardiol. … Continua a leggere, se eseguita nei pazienti ad alto rischio di un secondo evento, in aggiunta alla terapia anticoagulante, possa contribuire alla riduzione del rischio di ictus. Tale opzione terapeutica necessita, comunque, ancora di essere validata da studi clinici ad-hoc che ne dimostrino l’efficacia. Inoltre bisogna non dimenticare di indagare l’eziologia dell’evento cerebrale al fine di individuare la presenza di altri fattori predisponenti la cui correzione potrebbe contribuire a ridurre il rischio di recidiva. In un’analisi cumulativa di 11 coorti, provenienti da centri stroke in Svizzera e in Germania, si è visto come nei casi di fibrillazione atriale e ictus, nonostante terapia anticoagulante, in circa ¼ dei pazienti vi era un meccanismo concomitante indipendente dall’aritmia (malattia aterosclerotica dei grandi vasi, coagulopatie, endocardite,…). Inoltre, 1/3 dei pazienti non era stato scoagulato in maniera ottimale per dimenticanza o per dosaggio inadeguato del farmaco, quest’ultimo fattore associato a un aumento del rischio di ictus ischemico ricorrente anche negli studi presi in esame in questa analisi (per edoxaban 30 mg e dabigatran 110 mg). In un contesto in cui le possibilità terapeutiche per i pazienti ad alto rischio sono già evidentemente ridotte, risulta quindi di fondamentale importanza indagare, subito al momento del primo evento, l’eventuale presenza di fattori concomitanti, che possono portare a un secondo evento e procedere alla loro immediata correzione. In ultimo, diversi trial clinici[15]Glikson M, Wolff R, Hindricks G et al. EHRA/EAPCI expert consensus statement on catheter-based left atrial appendage occlusion – an update. Europace. 2020 Feb 1;22(2):184. … Continua a leggere[16]Piccini JP, Fraulo ES, Ansell JE, Fonarow GC, Gersh BJ, Go AS, Hylek EM, Kowey PR, Mahaffey KW, Thomas LE, Kong MH, Lopes RD, Mills RM, Peterson ED. Outcomes registry for better informed treatment of … Continua a leggere[17]Hakalahti A, Biancari F, Nielsen JC, Raatikainen MJ. Radiofrequency ablation vs. antiarrhythmic drug therapy as first line treatment of symptomatic atrial fibrillation: systematic review and … Continua a leggere, hanno dimostrato che l’ablazione transcatetere come prima opzione terapeutica sia più efficace della terapia farmacologica antiaritmica nel mantenimento a lungo termine del ritmo sinusale, motivo per cui, nelle linee guida correnti, questa ha un’indicazione di classe IIa nei pazienti con fibrillazione atriale parossistica e IIb nei pazienti con fibrillazione atriale persistente; l’ablazione trova invece indicazione di classe I solo nei pazienti in cui la terapia antiaritmica non è stata efficace o è stata mal tollerata[18]Erratum in: Eur Heart J. 2021 Feb 1;42(5):507. Erratum in: Eur Heart J. 2021 Feb 1;42(5):546-547. Erratum in: Eur Heart J. 2021 Oct 21;42(40):4194. PMID: 32860505.. Pur in assenza di dati certi, si è ipotizzato che il mantenimento del ritmo sinusale con l’uso dell’ablazione transcatetere possa ridurre significativamente il rischio di stroke[19]Chew D, Piccini JP. Long-term oral anticoagulant after catheter ablation for atrial fibrillation. Europace 2021 Aug 6;23(8):1157-1165.. In considerazione di questi dati, sarebbe dunque utile valutare l’ablazione nei pazienti con fibrillazione atriale e un primo evento cerebrale per ridurre più efficacemente il rischio di recidiva dell’aritmia e, di conseguenza, anche di un secondo evento cerebrale. In conclusione, lo studio analizzato ha chiaramente indicato come i pazienti con un evento ischemico cerebrale, nonostante terapia anticoagulante orale, costituiscano una popolazione ad alto rischio di recidiva precoce di eventi cerebrovascolari e di mortalità nel breve e medio termine. Questa popolazione di pazienti costituisce un vero “unmet clinical need” perché ad oggi non vi sono dati che possano suggerire una terapia adeguata per ridurre il rischio di recidive. In attesa di dati più certi dalla letteratura scientifica, il trattamento di questi pazienti non può se non essere individualizzato sul singolo paziente, tenendo conto del profilo di rischio ischemico-emorragico, della probabilità di altre cause di ictus e della eventuale possibilità di ridurre il rischio con opzioni terapeutiche quali l’ablazione transcatetere e la chiusura percutanea dell’auricola sinistra.
Bibliografia[+]
| ↑1 | Connolly SJ, Ezekowitz MD, Yusuf S, Eikelboom J, Oldgren J, Parekh A, et al. Dabigatran versus warfarin in patients with atrial fibrillation. N Engl J Med 2009;361:1139–1151. https://doi.org/10.1056/NEJMoa0905561. |
|---|---|
| ↑2 | Patel MR, Mahaffey KW, Garg J, Pan G, Singer DE, Hacke W, et al. Rivaroxaban versus warfarin in nonvalvular atrial fibrillation. N Engl J Med 2011;365:883–891. https://doi. org/10.1056/NEJMoa1009638. |
| ↑3 | Granger CB, Alexander JH, McMurray JJ, Lopes RD, Hylek EM, Hanna M, et al. Apixaban versus warfarin in patients with atrial fibrillation. N Engl J Med 2011;365:981–992. https://doi.org/10.1056/NEJMoa1107039 |
| ↑4 | Giugliano RP, Ruff CT, Braunwald E, Murphy SA, Wiviott SD, Halperin JL, et al. Edoxaban versus warfarin in patients with atrial fibrillation. N Engl J Med 2013;369: 2093–2104. https://doi.org/10.1056/NEJMoa1310907 |
| ↑5 | Klijn CJ, Paciaroni M, Berge E, Korompoki E, Kõrv J, Lal A, et al. Antithrombotic treatment for secondary prevention of stroke and other thromboembolic events in patients with stroke or transient ischemic attack and non-valvular atrial fibrillation: a European Stroke Organisation guideline. Eur Stroke J 2019;4:198–223. https://doi.org/10.1177/2396987319841187. |
| ↑6 | Yasuda S, Kaikita K, Akao M, Ako J, Matoba T, Nakamura M, et al. Antithrombotic therapy for atrial fibrillation with stable coronary disease. N Engl J Med 2019;381: 1103–1113. https://doi.org/10.1056/NEJMoa1904143. |
| ↑7 | Robert G. Hart, Lesly A. Pearce, Maria I. Aguilar. Meta-analysis: Antithrombotic Therapy to Prevent Stroke in Patients Who Have Nonvalvular Atrial Fibrillation. Ann Intern Med.2007;146:857-867. doi:10.7326/0003-4819-146-12-200706190- 00007. |
| ↑8 | Jan Steffel, Ronan Collins, Matthias Antz, Pieter Cornu, Lien Desteghe, Karl Georg Haeusler, Jonas Oldgren, Holger Reinecke, Vanessa Roldan-Schilling, Nigel Rowell, Peter Sinnaeve, Thomas Vanassche, Tatjana Potpara, A John Camm, Hein Heidbüchel, External reviewers, 2021 European Heart Rhythm Association Practical Guide on the Use of Non- Vitamin K Antagonist Oral Anticoagulants in Patients with Atrial Fibrillation, EP Europace, Volume 23, Issue 10, October 2021, Pages 1612–1676, https://doi.org/10.1093/europace/euab065 |
| ↑9 | Oldgren J, Åsberg S, Hijazi Z, Wester P, Bertilsson M, Norrving B; National TIMING Collaborators. Early Versus Delayed Non-Vitamin K Antagonist Oral Anticoagulant Therapy After Acute Ischemic Stroke in Atrial Fibrillation (TIMING): A Registry-Based Randomized Controlled Noninferiority Study. Circulation. 2022 Oct 4;146(14):1056-1066. doi: 10.1161/ CIRCULATIONAHA.122.060666. Epub 2022 Sep 6. Erratum in: Circulation. 2022 Nov 8;146(19):e279. PMID: 36065821; PMCID: PMC9648987. |
| ↑10 | Best JG, Arram L, Ahmed N, Balogun M, Bennett K, Bordea E, Campos MG, Caverly E, Chau M, Cohen H, Dehbi HM, Doré CJ, Engelter ST, Fenner R, Freemantle N, Hunter R, James M, Lip GY, Murray ML, Norrving B, Sprigg N, Veltkamp R, Zaczyk I, Werring DJ; OPTIMAS investigators. Optimal timing of anticoagulation after acute ischemic stroke with atrial fibrillation (OPTIMAS): Protocol for a randomized controlled trial. Int J Stroke. 2022 Jun;17(5):583-589. doi:10.1177/17474930211057722. Epub 2022 Jan 12. PMID: 35018878. |
| ↑11 | Alexander P Benz, Isabelle Johansson, Willem J M Dewilde, Renato D Lopes, Roxana Mehran, Samantha Sartori, Nikolaus Sarafoff, Satoshi Yasuda, William F, McIntyre, Jeff S Healey, Ashkan Shoamanesh, John W Eikelboom, Stuart J Connolly, Antiplatelet therapy in patients with atrial fibrillation: a systematic review and meta-analysis of randomized trials, European Heart Journal – Cardiovascular Pharmacotherapy, Volume 8, Issue 7, November 2022, Pages 648–659, https://doi.org/10.1093/ehjcvp/pvab044. |
| ↑12 | Yasuda S, Kaikita K, Akao M, Ako J, Matoba T, Nakamura M, Miyauchi K, Hagiwara N, Kimura K, Hirayama A, Matsui K, Ogawa H; AFIRE Investigators. Antithrombotic Therapy for Atrial Fibrillation with Stable Coronary Disease. N Engl J Med. 2019 Sep 19;381(12):1103-1113. doi:10.1056/NEJMoa1904143. Epub 2019 Sep 2. Erratum in: N Engl J Med. 2021 Oct 21;385(17):1632. PMID: 31475793. |
| ↑13 | Withlock RP, Belley-Cote EP, Paparella D, Healey JS, Brady K, Sharma M, et al. Left atrial appendage occlusion during cardiac surgery to prevent stroke. N Engl J Med 2021; 384: 2081-2091. https://doi.org/10.1056/NEJMoa2101897. |
| ↑14 | Turagam MK, Osmancik P, Neuzil P, Dukkipati SR, Reddy VY. Left Atrial Appendage Closure Versus Oral Anticoagulants in Atrial Fibrillation: A Meta-Analysis of Randomized Trials. J Am Coll Cardiol. 2020 Dec 8;76(23):2795-2797. doi:10.1016/j. jacc.2020.08.089. PMID: 33272374. |
| ↑15 | Glikson M, Wolff R, Hindricks G et al. EHRA/EAPCI expert consensus statement on catheter-based left atrial appendage occlusion – an update. Europace. 2020 Feb 1;22(2):184. doi:10.1093/europace/euz258. Epub 2019 Aug 31. PMID: 31504441Cosedis Nielsen J, Johannessen A, Raatikainen P, Hindricks G, Walfridsson H, Kongstad O, Pehrson S, Englund A, Hartikainen J, Mortensen LS, Hansen PS. Radiofrequency ablation as initial therapy in paroxysmal atrial fibrillation. N Engl J Med. 2012 Oct 25;367(17):1587-95. doi:10.1056/NEJMoa1113566. PMID: 23094720. |
| ↑16 | Piccini JP, Fraulo ES, Ansell JE, Fonarow GC, Gersh BJ, Go AS, Hylek EM, Kowey PR, Mahaffey KW, Thomas LE, Kong MH, Lopes RD, Mills RM, Peterson ED. Outcomes registry for better informed treatment of atrial fibrillation: rationale and design of ORBIT-AF. Am Heart J. 2011 Oct;162(4):606-612.e1. doi:10.1016/j.ahj.2011.07.001. PMID: 21982650 |
| ↑17 | Hakalahti A, Biancari F, Nielsen JC, Raatikainen MJ. Radiofrequency ablation vs. antiarrhythmic drug therapy as first line treatment of symptomatic atrial fibrillation: systematic review and meta-analysis. Europace. 2015 Mar;17(3):370-8. doi:10.1093/europace/euu376. Epub 2015 Feb 1. PMID: 25643988. 12. Hindricks G, Potpara T, Dagres N, Arbelo E, Bax JJ, Blomström-Lundqvist C, Boriani G, Castella M, Dan GA, Dilaveris PE, Fauchier L, Filippatos G, Kalman JM, La Meir M, Lane DA, Lebeau JP, Lettino M, Lip GYH, Pinto FJ, Thomas GN, Valgimigli M, Van Gelder IC, Van Putte BP, Watkins CL; ESC Scientific Document Group. 2020 ESC Guidelines for the diagnosis and management of atrial fibrillation developed in collaboration with the European Association for Cardio-Thoracic Surgery (EACTS): The Task Force for the diagnosis and management of atrial fibrillation of the European Society of Cardiology (ESC) Developed with the special contribution of the European Heart Rhythm Association (EHRA) of the ESC. Eur Heart J. 2021 Feb 1;42(5):373-498. doi:10.1093/eurheartj/ehaa6 |
| ↑18 | Erratum in: Eur Heart J. 2021 Feb 1;42(5):507. Erratum in: Eur Heart J. 2021 Feb 1;42(5):546-547. Erratum in: Eur Heart J. 2021 Oct 21;42(40):4194. PMID: 32860505. |
| ↑19 | Chew D, Piccini JP. Long-term oral anticoagulant after catheter ablation for atrial fibrillation. Europace 2021 Aug 6;23(8):1157-1165. |
Accedi per leggere tutto l'articolo
Inserisci i dati del tuo account su Cardiotalk per accedere e leggere tutto il contenuto dell'articolo.
Se non hai un account, clicca sul pulsante registrati e verrai reindirizzato al portale Cardiotalk per la registrazione.

