Inquadramento
La fibrillazione ventricolare idiopatica (FVI) rappresenta il substrato aritmico di arresti cardiaci che si presentano in soggetti senza evidente cardiopatia ischemica o strutturale, nè anomalie su base genetica. In alcuni di questi casi l’aritmia è scatenata da extrasistoli ventricolari molto precoci, cosi da poter configurare una entità aritmica, ma anche clinica, distinta da altre forme di FVI.
Lo studio in esame
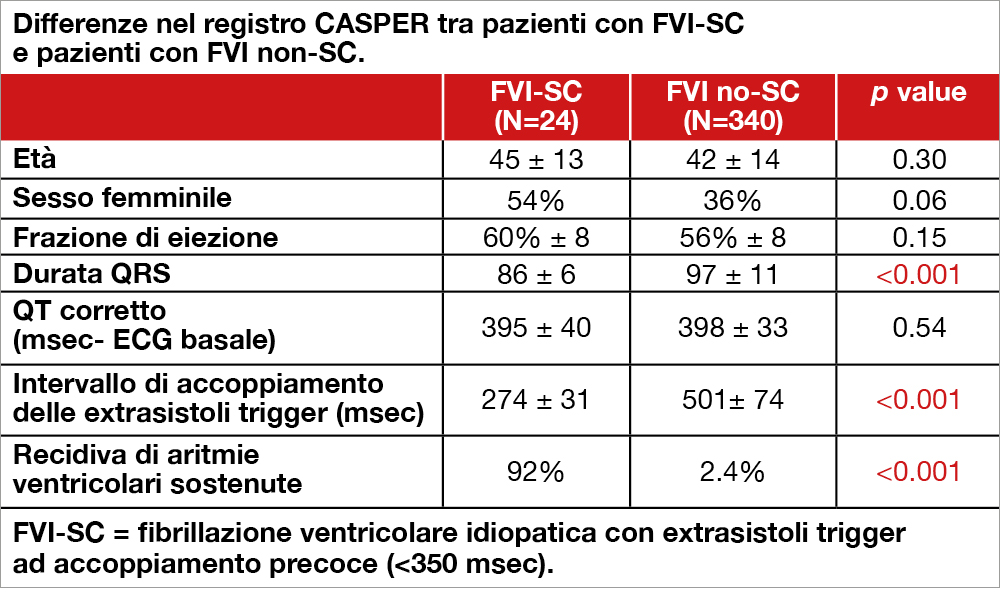
Analisi condotta nell’ambito dello studio CASPER, un registro canadese che raccoglie informazioni su pazienti sopravvissuti ad arresto cardiaco senza patologia coronarica e con frazione di eiezione conservata[1]Krahn AD, Healey JS, Chauhan V, et al. Systematic assessment of patients with unexplained cardiac arrest: Cardiac Arrest Survivors With Preserved Ejection Fraction Registry (CASPER). Circulation … Continua a leggere. Di 364 pazienti con FVI (dopo l’esclusione dei pazienti con patologia elettrica o miocardica su base genetica), sono stati individuati 24 pazienti (6.6%) con ricorrenti episodi di tachicardia ventricolare o FV, scatenati da extrasistoli ventricolari con accoppiamento molto precoce, <350 msec (FVI-SC). Le caratteristiche cliniche di questi pazienti (rispetto ai rimanenti 340 pazienti con FVI non-SC, vedi Tabella) indicano una maggior propensione a recidive aritmiche sostenute nel corso del follow-up (mediana 51 mesi). Non sono state riscontrate anomalie genetiche nella popolazione FVI-SC. È stata infine mostrata una buona risposta clinica alla somministrazione di chinidina.
Take home message
La FVI-SC rappresenta una sindrome aritmica distinta da altre forme di FVI. La prevalenza di questo fenotipo non è nota, in quanto la diagnosi è spesso effettuata sulla base della registrazione ECG del defibrillatore in caso di recidiva. La terapia con chinidina sembra promettente nel ridurre nuovi eventi aritmici.
Interpretazione dei dati
Gli Autori, nella discussione, sottolineano il ruolo patogenetico delle fibre di Purkinje in particolare l’aumentata attività del canale Ito (corrente di uscita del potassio) di queste fibre, nell’indurre extrasistoli ventricolari ad accoppiamento molto precoce[2]Xiao L, Koopmann TT, Ordog B, et al. Unique cardiac Purkinje fiber transient outward current beta-subunit composition: a potential molecular link to idiopathic ventricular fibrillation.Circ Res … Continua a leggere. Una ulteriore prova al riguardo, sarebbe l’azione efficace della chinidina nel prevenire questa tipologia di aritmie, in quanto il farmaco è un potente inibitore del canale Ito. In questo senso il fenotipo di FVI appare simile dal punto di vista patogenetico e per il meccanismo di innesco dell’aritmia alla sindrome di Brugada. Un altro aspetto clinico di similitudine tra il fenotipo FVI-SC e la sindrome di Brugada, riguarda l’insorgenza dell’aritmia che avviene durante le fasi di ipertono vagale, quali il sonno e il riposo.
L’opinione di Massimo Tritto
Humanitas Mater Domini, Castellanza e Humanitas University, Rozzano
La morte cardiaca improvvisa (MCI) è un evento drammatico, soprattutto quando si verifica in soggetti giovani e apparentemente sani. In questo contesto, l’identificazione e la caratterizzazione di un particolare fenotipo a rischio riveste una importante rilevanza clinica. In questo lavoro gli Autori analizzano un’ampia popolazione di soggetti (364) arruolati nel registro CASPER con FV considerata idiopatica, dopo l’esclusione di una cardiopatia strutturale e/o di una malattia dei canali ionici[3]Krahn AD, Healey JS, Chauhan V, et al. Systematic assessment of patients with unexplained cardiac arrest: Cardiac Arrest Survivors With Preserved Ejection Fraction Registry (CASPER). Circulation … Continua a leggere. Tra questi, in un sottogruppo di individui (24/364; 6.6%) l’aritmia era tipicamente innescata da extrasistoli ventricolari con intervallo di accoppiamento breve (≤350 ms; in media 274±31 ms). La relazione tra precocità dell’intervallo di accoppiamento delle extrasistoli ventricolari (che cadono nella fase “vulnerabile” della ripolarizzazione ventricolare) e rischio di innesco di aritmie ventricolari maligne era già stata da tempo descritta in letteratura nell’ambito di differenti contesti clinici, inclusi i soggetti con cuore apparentemente sano. Tuttavia, in questo studio per la prima volta viene identificata, tra i pazienti con FV idiopatica (considerata tale dopo la sistematica esclusione delle cause secondarie note), una specifica popolazione in cui le extrasistoli con breve intervallo di accoppiamento hanno caratteristiche di particolare malignità clinica come anche dimostrato dal maggior numero di recidive aritmiche (2.21/100pz/mese) registrate in un follow-up relativamente breve (mediana 51 mesi) rispetto alla popolazione di controllo (0.05/100pz/mese). Questi dati vanno ovviamente considerati con particolare attenzione e non possono essere semplicisticamente traslati nella pratica clinica. Infatti, essi derivano da un’analisi retrospettiva eseguita in una popolazione selezionata di pazienti sopravvissuti ad arresto cardiaco e pertanto, mancando un gruppo di controllo rappresentato dalla popolazione generale a rischio dell’evento, la prima di prevalenza del meccanismo così come la specificità e il valore prognostico dell’intervallo di accoppiamento delle extrasi-stoli ventricolari nel misurare il rischio di MCI, rimangono ancora ignoti. Un altro aspetto clinicamente rilevante riguarda la possibile presenza di un “substrato” alla base di questo particolare fenotipo. A questo riguardo, i dati del registro sono purtroppo incompleti. Infatti, sebbene sia indicato dagli Autori che la maggior parte dei pazienti erano stati sottoposti a risonanza magnetica nucleare cardiaca, i risultati non vengono riportati. Analogamente, in questi pazienti non è stato eseguito un mappaggio 3D elettro-anatomico delle camere ventricolari. La mancanza di queste informazioni rappresenta un punto debole dello studio, in quanto dati recenti dimostrano che, tra i soggetti con aritmie ventricolari e cuore apparentemente sano, la presenza di alterazioni strutturali alla risonanza magnetica individua un sottogruppo di individui a rischio particolarmente elevato di eventi aritmici/MCI[4]Nucifora G, Muser D, Masci PG, et al. Prevalence and prognostic value of concealed structural abnormalities in patientw with apparently idiopathic ventricular arrhythmias of left versus right … Continua a leggere[5]Muser D, Nucifora G, Pieroni M, et al. Prognostic value of nonischemic ringlike left ventricular scar in patients with apparently idiopathic nonsustained ventricular arrhythmias. Circulation … Continua a leggere. Analogamente, Haissaguerre e coll.[6]Haissaguerre M, Hocini M, Cheniti G, et al. Localized structural alterations underlying a subset of unexplained cardiac death. Circ Arrhythm Electrophysiol 2018;11:e006120., mediante mappaggio elettroanatomico, hanno dimostrato la presenza di “elettrogrammi anormali”, possibile espressione di alterazioni strutturali “nascoste”, in una percentuale elevata (62.5%) di pazienti con FVI. Pertanto, l’insieme di queste osservazioni, dovrebbero orientare sempre più la ricerca verso l’individuazione – attraverso metodiche di imaging avanzato – di alterazioni strutturali/ ultrastrutturali come marker di rischio di MCI in soggetti con aritmia extrasistolica ventricolare e cuore apparentemente sano. Dal punto di vista fisiopatologico, si ipotizza che un alterato funzionamento del canale di membrana Ito prevalentemente a carico delle fibre che compongono la rete di Purkinje sia responsabile dell’aritmogenicità spiccata di questi tessuti[7]Xiao L, Koopmann TT, Ordog B, et al. Unique cardiac Purkinje fiber transient outward current beta-subunit composition: a potential molecular link to idiopathic ventricular fibrillation.Circ Res … Continua a leggere. Se questa alterazione sia geneticamente determinata e/o secondaria a danno ultrastrutturale non è completamente noto. La rara trasmissione familiare e l’assenza di alterazioni genetiche, nella popolazione dello studio, alimentano i dubbi a riguardo di questo importante aspetto che dovrà essere chiarito in studi futuri utilizzando pannelli genetici più ampi. Tuttavia, il meccanismo patogenetico ipotizzato sembra essere indirettamente supportato dalla risposta al trattamento con chinidina (che inibisce il canale Ito), in grado di ridurre fortemente le recidive aritmiche nel follow-up di questi pazienti. Anche questa è un’importante osservazione che dovrebbe spingere a una maggiore attenzione verso l’utilizzo di un farmaco considerato obsoleto e ormai di difficile reperimento sul mercato, a causa della sua ridotta produzione industriale. Infine, per quanto riguarda il trattamento, le extrasistoli ventricolari rappresentano il trigger principale per l’innesco della FV e quindi un target affidabile per l’ablazione transcatetere. Pertanto, l’identificazione della loro possibile sede di origine attraverso l’analisi della morfologia alle registrazioni ECG a 12 derivazioni è di fondamentale importanza e andrebbe accuratamente ricercata al fine di permettere l’esecuzione dell’ablazione che, in studi preliminari[8]Haissaguerre M, Hocini M, Cheniti G, et al. Localized structural alterations underlying a subset of unexplained cardiac death. Circ Arrhythm Electrophysiol 2018;11:e006120., si è rivelata sicura ed efficace nel trattamento di casi selezionati (ad esempio nei soggetti con interventi frequenti dell’ICD o in storm aritmico).
Bibliografia[+]
| ↑1, ↑3 | Krahn AD, Healey JS, Chauhan V, et al. Systematic assessment of patients with unexplained cardiac arrest: Cardiac Arrest Survivors With Preserved Ejection Fraction Registry (CASPER). Circulation 2009;120:278–285. |
|---|---|
| ↑2, ↑7 | Xiao L, Koopmann TT, Ordog B, et al. Unique cardiac Purkinje fiber transient outward current beta-subunit composition: a potential molecular link to idiopathic ventricular fibrillation.Circ Res 2013;112:1310–1322. |
| ↑4 | Nucifora G, Muser D, Masci PG, et al. Prevalence and prognostic value of concealed structural abnormalities in patientw with apparently idiopathic ventricular arrhythmias of left versus right ventricular origin. Circ Arrhythm Electrophysiol 2014;7:456-62. |
| ↑5 | Muser D, Nucifora G, Pieroni M, et al. Prognostic value of nonischemic ringlike left ventricular scar in patients with apparently idiopathic nonsustained ventricular arrhythmias. Circulation 2021;143:1359-73. |
| ↑6, ↑8 | Haissaguerre M, Hocini M, Cheniti G, et al. Localized structural alterations underlying a subset of unexplained cardiac death. Circ Arrhythm Electrophysiol 2018;11:e006120. |
Accedi per leggere tutto l'articolo
Inserisci i dati del tuo account su Cardiotalk per accedere e leggere tutto il contenuto dell'articolo.
Se non hai un account, clicca sul pulsante registrati e verrai reindirizzato al portale Cardiotalk per la registrazione.

