Inquadramento
La composizione e durata della doppia terapia antiaggregante nei pazienti con sindrome coronarica acuta (ACS), deve essere commisurata al rischio emorragico e ischemico dei pazienti. Gli score di più ampio utilizzo hanno tuttavia alcune limitazioni: essi sono basati su casistiche che includono anche gli eventi del primo mese successivo all’evento indice (periodo nel quale, pur essendo gli eventi più numerosi, non esistono incertezze sulla composizione della DAPT) e non sono stati derivati da simili popolazioni target.
Lo studio in esame
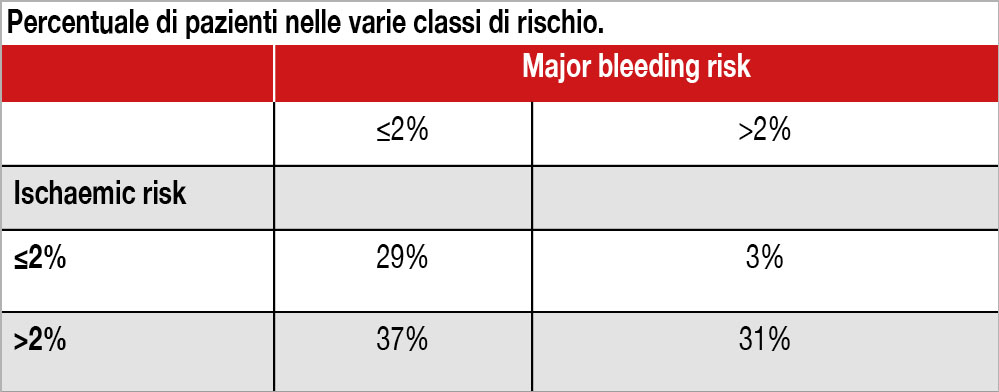
Analisi basata su un registro neozelandese di 27.755 pazienti consecutivi con ACS, indenni da eventi nei primi 28 giorni successivi all’evento indice. L’inclusione dei pazienti nel registro era obbligatoria se era stata eseguita una coronarografia. Venivano esclusi i pazienti con fibrillazione atriale accertata e quelli in terapia anticoagulante nei 6 mesi precedenti l’evento o nei 3 mesi successivi a esso. L’età media era 66 anni, il 22% aveva diabete e il 28% storia di malattia cardiovascolare; nel 27% era diagnosticato STEMI, NSTEMI nel 56% dei pazienti. Nel periodo compreso tra il 29esimo e 365esimo giorno post-ACS, si sono verificati 1.200 eventi ischemici (morte cardiovascolare, ospedalizzazione per infarto miocardico e stroke) pari al 4.3% e 548 eventi emorragici (ospedalizzazione e/o mortalità per bleeding) pari al 2%. In base a una analisi multivariata che ha incluso 24 variabili, sono stati costruiti score di rischio ishemico ed emorragico che venivano calcolati per ciascun paziente. Un rischio elevato indicava una probabilità di eventi >4%, un rischio intermedio tra il 2% e il 4%, un rischio basso <2%. Per l’85% dei pazienti, il rischio di avere un evento ischemico superava il rischio di major bleeding (mediana della differenza assoluta 1.2%, IQR 0.5%–2.8%) e il 42% presentava un rischio ischemico almeno doppio rispetto a un rischio di major bleeding. Esisteva una correlazione moderata tra rischio individuale ischemico e rischio di major bleeding (r=0.643, 95% CI 0.636 a 0.650). La mediana del rischio ischemico aumentava dal 2.2% al 4.3% al 9.2% in corrispondenza di un basso (≤2%), intermedio (>2% a <4%) e alto (>4%) rischio emorragico. La percentuale dei pazienti dell’intera casistica, classificati in base a rischio ischemico ed emorragico almeno di grado intermedio (>2% anno) sono espresse nella Tabella.
Take home message
In questo registro “real-world” di pazienti ACS, lo sviluppo simultaneo di score di rischio ischemico ed emorragico per eventi che possano verificarsi tra il 29esimo giorno e 1 anno, permette di “personalizzare” il tipo di DAPT da effettuare.
Interpretazione dei dati
I dati rilevanti di questo interessante studio sono:
- il rischio ischemico a 1 anno è circa il doppio rispetto al rischio di bleeding;
- nel 30% dei pazienti è presente un basso rischio sia ischemico che di bleeding;
- la stragrande maggioranza dei pazienti a rischio di bleeding intermedio/alto ha anche un rischio ishemico intermedio/alto.
Gli Autori sottolineano l’originalità della loro analisi in quanto studi analoghi, come il PARIS[1]Baber U, Mehran R, Giustino G, et al. Coronary thrombosis and major bleeding after PCI with drug-Eluting Stents: risk scores from PARIS. J Am Coll Cardiol 2016;67:2224–34. e il DAPT[2]Yeh RW, Secemsky EA, Kereiakes DJ, et al. Development and validation of a prediction rule for benefit and harm of dual antiplatelet therapy beyond 1 year after percutaneous coronary intervention. … Continua a leggere avevano incluso casistiche miste di pazienti stabili e ACS, mentre lo studio PRAISE aveva derivato gli score da una casistica ACS includendo il primo mese successivo all’evento acuto[3]D’Ascenzo F, De Filippo O, Gallone G, et al. PRAISE study group. Machine learning-based prediction of adverse events following an acute coronary syndrome (PRAISE): a modelling study of pooled … Continua a leggere. I risultati di questa analisi possono offrire una base per personalizzare la DAPT nei pazienti ACS. A tal fine le Linee Guida[4]Byrne RA, Rossello X, Coughlan JJ, et al. ESC Scientific Document Group. 2023 ESC Guidelines for the management of acute coronary syndromes. Eur Heart J Acute Cardiovasc Care. 2023 Sep 22:zuad107. … Continua a leggere ribadiscono l’importanza di accertare, nel singolo paziente, sia il rischio ischemico che emorragico, tuttavia una stima quantitativa è possibile solo per quest’ultimo, mentre per il rischio ischemico vengono proposte solo valutazioni qualitative, se si eccettua il DAPT score che peraltro è obsoleto e riguarda il rischio a partire dalla fine del primo anno di follow-up[5]Yeh RW, Secemsky EA, Kereiakes DJ, et al. Development and validation of a prediction rule for benefit and harm of dual antiplatelet therapy beyond 1 year after percutaneous coronary intervention. … Continua a leggere.
Questo studio ha il pregio di oggettivare in termini quantitativi anche il rischio ischemico, tuttavia il suo calcolo non è immediato e, a giudicare dalle tabelle presenti, abbastanza indaginoso. Invece sarebbe auspicabile la costruzione di uno score semplice, basato su poche variabili (come per il bleeding) e facilmente calcolabile. I trial clinici futuri dovrebbero testare varie possibilità di DAPT a partire da pazienti selezionati in base a diverse classificazioni di rischio, soprattutto nei pazienti più complessi, quali quelli che presentino sia un elevato rischio ischemico che emorragico.
Editoriale: “Terapia individualizzata dopo sindrome coronarica acuta: alla ricerca del sacro Graal”
A cura di: Claudio Montalto, ASST Grande Ospedale Metropolitano Niguarda; “De Gasperis” Cardiocenter, Milano
In tempi recenti, la durata ottimale della duplice terapia antiaggregante (DAPT), dopo un intervento di angioplastica (PCI) o sindrome coronarica acuta (ACS) è stato oggetto di ampio dibattito scientifico e soggetto di intensa ricerca, distribuita su tutto il globo (numerosi sono stati i trial occidentali tanto quelli orientali). Inoltre, dopo anni di enfasi sul rischio di recidiva ischemica (infarto, morte cardiovascolare), si è posta una progressiva attenzione sul rischio di sanguinamento, storicamente poco ponderato anche a fronte di un rischio ischemico molto elevato osservato nei primi anni di PCI. Parte di questa complessità deriva anche dal progresso, sia in termini farmacologici sia in termini di materiali e tecniche utilizzate (stent di ultima generazione, incremento dell’uso di imaging intravascolare), ma anche da un uso più “minimalista” degli stent, questi ultimi difficili da misurare in termini scientifici. Il risultato è stato declinare l’apparente semidicotomicità del problema clinico – DAPT breve vs lunga, P2Y12-inibitore (i) potente vs clopidogrel – in una moltitudine di rivoli possibili che, offrendo una molteplicità di possibilità, anziché semplificare il lavoro del clinico lo hanno apparentemente complicato. In tal senso, abbiamo visto anche fiorire numerosi score dedicati a quantificare il rischio di recidiva ischemica e di sanguinamento, con l’idea sottostante che possano aiutare il clinico a dirimere la questione di quale DAPT prescrivere, e per quanto tempo, in casi in cui uno dei due sia particolarmente sbilanciato. Le Linee Guida europee suggeriscono l’uso del PRECISE-DAPT score,[6]Costa F, Klaveren D van, James S, Heg D, Räber L, Feres F, Pilgrim T, Hong MK, Kim HS, Colombo A, Steg PG, Zanchin T, Palmerini T, Wallentin L, Bhatt DL, Stone GW, Windecker S, Steyerberg EW, … Continua a leggere oppure della definizione ARC-HBR,[7]Urban P, Mehran R, Colleran R, Angiolillo DJ, Byrne RA, Capodanno D, Cuisset T, Cutlip D, Eerdmans P, Eikelboom J, Farb A, Gibson CM, Gregson J, Haude M, James SK, Kim HS, Kimura T, Konishi A, … Continua a leggere per individuare il paziente ad alto rischio emorragico (ovvero, incidenza di sanguinamenti maggiori >4% a 1 anno) e che pertanto potrebbe beneficiare di una DAPT meno potente (durata minore, uso di P2Y12-i non potente, de-escalation). Per individuare un elevato rischio ischemico esiste il DAPT score,[8]Yeh RW, Secemsky EA, Kereiakes DJ, Normand SLT, Gershlick AH, Cohen DJ, Spertus JA, Steg PG, Cutlip DE, Rinaldi MJ, Camenzind E, Wijns W, Apruzzese PK, Song Y, Massaro JM, Mauri L. Development and … Continua a leggere ma anche criteri “procedurali”[9]Giustino G, Chieffo A, Palmerini T, Valgimigli M, Feres F, Abizaid A, Costa RA, Hong M-K, Kim B-K, Jang Y, Kim H-S, Park KW, Gilard M, Morice M-C, Sawaya F, Sardella G, Genereux P, Redfors B, Leon … Continua a leggere. Negli ultimi anni numerosi studi randomizzati hanno dimostrato come nei pazienti a elevato rischio di sanguinamento, questo dovrebbe prevalere, invitando il clinico a sbilanciarsi verso una DAPT più breve (fino a 1 mese o 1 settimana se il paziente è in terapia anticoagulante), indipendentemente dal rischio ischemico.[10]Montalto C, Costa F, Leonardi S, Micari A, Oreglia JA, Vranckx P, Capodanno D, Berg J ten, Lopes RD, Valgimigli M. Dual antiplatelet therapy duration after percutaneous coronary intervention in … Continua a leggere[11]Costa F, Montalto C, Branca M, Hong S-J, Watanabe H, Franzone A, Vranckx P, Hahn J-Y, Gwon H-C, Feres F, Jang Y, Luca G De, Kedhi E, Cao D, Steg PG, Bhatt DL, Stone GW, Micari A, Windecker S, Kimura … Continua a leggere Ciò conferisce un vantaggio in termini di riduzione di sanguinamenti maggiori (con impatto sulla mortalità) senza apparentemente incrementare il rischio ischemico residuo. Persiste però un problema per i pazienti a elevato rischio ischemico, quali sono, per definizione, i pazienti post-ACS: esiste anche qui una soglia oltre cui il rischio di sanguinamento supera, per importanza prognostica, quello del rischio ischemico? In tal senso l’articolo di Kerr e colleghi[12]Kerr AJ, Choi Y, Williams MJ, Stewart RA, White HD, Devlin G, Selak V, Lee MAW, El-Jack S, Adamson PD, Fairley S, Jackson RT, Poppe K. Paired risk scores to predict ischaemic and bleeding risk … Continua a leggere ci fornisce un’interessante analisi di un ampio database amministrativo della Nuova Zelanda che coinvolge oltre 20.000 pazienti ACS in un arco temporale di circa 10 anni. Gli Autori riconoscono un limite degli attuali strumenti a disposizione (vedi i già citati PRECISE-DAPT e DAPT score), ovvero che dalle popolazioni di riferimento era stato derivato alternativamente o il rischio ischemico o il rischio emorragico e mai entrambi. Pertanto, la validazione e un eventuale trade-off di rischio risultano degli esercizi posticci e non del tutto generalizzabili. In questo caso gli Autori, partendo da un’ampia numerosità, derivano due score di rischio, uno di eventi ischemici (morte cardiovascolare, recidiva di evento ischemico) e uno di sanguinamento maggiore. Non ci sono sorprese per quanto riguarda i predittori di rischio, che includono, come già noto, età, sesso, filtrato renale, anemizzazione, etc. Più interessante è la categorizzazione dei pazienti, con il 31% di una coorte di all-comers con ACS che ricade in entrambe le categorie di alto rischio ischemico ed emorragico. Infine, utile la considerazione degli Autori di includere solo pazienti senza eventi a 1 mese, in quanto chi avrà avuto un evento, che sia ischemico o emorragico, cadrà in automatico in una delle due categorie di rischio, senza bisogno di calcolare alcuno score. A mio modesto modo di vedere, l’articolo non aggiunge in maniera significativa alla letteratura, già molto abbondante, ma di fatto conferma i già noti fattori di rischio ischemici ed emorragici, anche in una popolazione molto ampia e di un paese remoto e raramente studiato in grandi trial randomizzati. Inoltre, gli Autori mettono una giusta enfasi su un cut-off temporale, ovvero 1 mese dopo una ACS, cruciale perché, anche nel nostro sistema, il paziente resterà spesso senza successivi controlli programmati per i 5 mesi successivi. È dunque uno snodo cruciale per decidere se e come modificare la DAPT e qui si deve porre la giusta attenzione per calibrare il rischio residuo del paziente, elemento necessario per la famosa “individualizzazione” della terapia. Il paper propone, a seconda di cut-off di rischio arbitrari (2% annuo sia per il rischio ischemico che emorragico), come ciascun gruppo di pazienti possa beneficiare di una strategia “alternativa” (DAPT abbreviata vs prolungata vs standard), ma non aggiunge se esiste una soglia di rischio “eccessivo” per cui massimizzare gli sforzi terapeutici verso l’una o l’altra strada. Questo, che è un po’ il sacro Graal della ricerca in ambito DAPT, resta uno sforzo complesso e ancora lontano dall’orizzonte.
Bibliografia[+]
| ↑1 | Baber U, Mehran R, Giustino G, et al. Coronary thrombosis and major bleeding after PCI with drug-Eluting Stents: risk scores from PARIS. J Am Coll Cardiol 2016;67:2224–34. |
|---|---|
| ↑2, ↑5 | Yeh RW, Secemsky EA, Kereiakes DJ, et al. Development and validation of a prediction rule for benefit and harm of dual antiplatelet therapy beyond 1 year after percutaneous coronary intervention. JAMA 2016;315:1735–49. |
| ↑3 | D’Ascenzo F, De Filippo O, Gallone G, et al. PRAISE study group. Machine learning-based prediction of adverse events following an acute coronary syndrome (PRAISE): a modelling study of pooled datasets.Lancet. 2021 Jan 16;397(10270):199-207. doi:10.1016/S0140-6736(20)32519-8. |
| ↑4 | Byrne RA, Rossello X, Coughlan JJ, et al. ESC Scientific Document Group. 2023 ESC Guidelines for the management of acute coronary syndromes. Eur Heart J Acute Cardiovasc Care. 2023 Sep 22:zuad107. doi:10.1093/ehjacc/zuad107. |
| ↑6 | Costa F, Klaveren D van, James S, Heg D, Räber L, Feres F, Pilgrim T, Hong MK, Kim HS, Colombo A, Steg PG, Zanchin T, Palmerini T, Wallentin L, Bhatt DL, Stone GW, Windecker S, Steyerberg EW, Valgimigli M. Derivation and validation of the predicting bleeding complications in patients undergoing stent implantation and subsequent dual antiplatelet therapy (PRECISE-DAPT) score: a pooled analysis of individual-patient datasets from clinical trials. Lancet Elsevier Ltd; 2017;389:1025–1034. |
| ↑7 | Urban P, Mehran R, Colleran R, Angiolillo DJ, Byrne RA, Capodanno D, Cuisset T, Cutlip D, Eerdmans P, Eikelboom J, Farb A, Gibson CM, Gregson J, Haude M, James SK, Kim HS, Kimura T, Konishi A, Laschinger J, Leon MB, Magee PFA, Mitsutake Y, Mylotte D, Pocock S, Price MJ, Rao S V., Spitzer E, Stockbridge N, Valgimigli M, Varenne O, et al. Defining High Bleeding Risk in Patients Undergoing Percutaneous Coronary Intervention. Circulation NLM (Medline); 2019;140:240–261. |
| ↑8 | Yeh RW, Secemsky EA, Kereiakes DJ, Normand SLT, Gershlick AH, Cohen DJ, Spertus JA, Steg PG, Cutlip DE, Rinaldi MJ, Camenzind E, Wijns W, Apruzzese PK, Song Y, Massaro JM, Mauri L. Development and validation of a prediction rule for benefit and harm of Dual antiplatelet therapy beyond 1 year after percutaneous coronary intervention. JAMA – J Am Med Assoc 2016;315:1735–1749. |
| ↑9 | Giustino G, Chieffo A, Palmerini T, Valgimigli M, Feres F, Abizaid A, Costa RA, Hong M-K, Kim B-K, Jang Y, Kim H-S, Park KW, Gilard M, Morice M-C, Sawaya F, Sardella G, Genereux P, Redfors B, Leon MB, Bhatt DL, Stone GW, Colombo A. Efficacy and Safety of Dual Antiplatelet Therapy After Complex PCI. J Am Coll Cardiol 2016;68:1851–1864 |
| ↑10 | Montalto C, Costa F, Leonardi S, Micari A, Oreglia JA, Vranckx P, Capodanno D, Berg J ten, Lopes RD, Valgimigli M. Dual antiplatelet therapy duration after percutaneous coronary intervention in patients with indication to oral anticoagulant therapy. A systematic review and meta-analysis of randomized controlled trials. Eur Hear J – Cardiovasc Pharmacother 2023;9:220–230. |
| ↑11 | Costa F, Montalto C, Branca M, Hong S-J, Watanabe H, Franzone A, Vranckx P, Hahn J-Y, Gwon H-C, Feres F, Jang Y, Luca G De, Kedhi E, Cao D, Steg PG, Bhatt DL, Stone GW, Micari A, Windecker S, Kimura T, Hong M-K, Mehran R, Valgimigli M. Dual antiplatelet therapy duration after percutaneous coronary intervention in high bleeding risk: a metaanalysis of randomized trials. Eur Heart J England; 2023;44:954–968. |
| ↑12 | Kerr AJ, Choi Y, Williams MJ, Stewart RA, White HD, Devlin G, Selak V, Lee MAW, El-Jack S, Adamson PD, Fairley S, Jackson RT, Poppe K. Paired risk scores to predict ischaemic and bleeding risk twenty-eight days to one year after an acute coronary syndrome. Heart England; 2023;109:1827–1836. |
Accedi per leggere tutto l'articolo
Inserisci i dati del tuo account su Cardiotalk per accedere e leggere tutto il contenuto dell'articolo.
Se non hai un account, clicca sul pulsante registrati e verrai reindirizzato al portale Cardiotalk per la registrazione.

