Inquadramento
La terapia antitrombotica nei pazienti sottoposti a impianto percutaneo di valvola aortica (TAVI) non ha basi solide in letteratura. La pratica clinica attuale prevede 3 mesi di duplice terapia antiaggregante (DAPT) con ASA e clopidogrel, seguita da una terapia antiaggregante singola (SAPT) a vita. Le linee guida dell’European Sociey of Cardiology sulle valvulopatie[1]Baumgartner H, Falk V, Bax JJ, De Bonis M, Hamm C, Holm PJ, et al. 2017 ESC/EACTS Guidelines for the management of valvular heart disease. Eur Heart J. 2017;38(36):2739-91., pubblicate nel 2017, riconoscono un’indicazione di classe IIa con livello di evidenza C per una DAPT di 3/6 mesi. Le linee guida dell’American Heart Association/American College of Cardiology[2]Nishimura RA, Otto CM, Bonow RO, Carabello BA, Erwin JP, 3rd, Fleisher LA, et al. 2017 AHA/ACC Focused Update of the 2014 AHA/ACC Guideline for the Management of Patients With Valvular Heart Disease: … Continua a leggere, in maniera similare, consigliano una DAPT di 6 mesi, mentre le linee guida della Canadian Cardiovascular Society[3]Asgar AW, Ouzounian M, Adams C, Afilalo J, Fremes S, Lauck S, et al. 2019 Canadian Cardiovascular Society Position Statement for Transcatheter Aortic Valve Implantation. Can J Cardiol. … Continua a leggere indicano la DAPT solo in caso di PCI recente. Anche le già citate LG ESC suggeriscono la possibilità di evitare la DAPT, tuttavia solo nei casi a rischio emorragico elevato (classe IIb LOE C).
Lo studio in esame
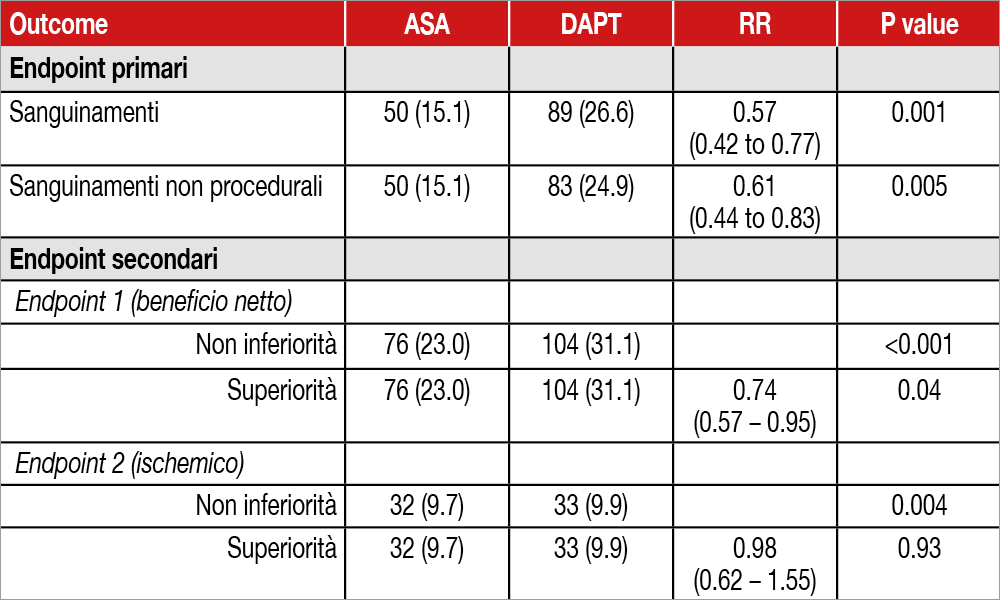
Il trial ha arruolato 665 pazienti TAVI che non presentavano indicazione a terapia anticoagulante orale. Il disegno dello studio prevedeva la randomizzazione a DAPT con ASA/ Clopidogrel per 3 mesi seguiti da sola ASA o a SAPT con ASA in rapporto 1:1. I due endpoint primari dello studio erano: 1. Sanguinamenti di qualsiasi entità; 2. Sanguinamenti non legati alla procedura, registrati nell’arco di 12 mesi. Endpoint secondari erano invece: 1. Combinazione di morte cardiovascolare, sanguinamenti non procedurali, infarto e ictus di qualsiasi natura; 2. Combinazione di morte cardiovascolare, ictus ischemico e infarto. L’ipotesi principale dello studio era documentare se la SAPT potesse risultare superiore rispetto a DAPT, rispetto ai sanguinamenti (endpoint primari), testando allo stesso tempo la non inferiorità in merito agli endpoint secondari. Da notare che lo studio ha utilizzato, per i sanguinamenti, la definizione VARC2[4]Kappetein AP, Head SJ, Genereux P, Piazza N, van Mieghem NM, Blackstone EH, et al. Updated standardized endpoint definitions for transcatheter aortic valve implantation: the Valve Academic Research … Continua a leggere. L’età media dei pazienti in studio era di 80 anni, 49% di donne. Circa 1 paziente su 5 presentava un quadro di stenosi aortica low-flow low-gradient: 75% dei pazienti aveva frazione di eiezione del ventricolo sinistro >50%. I risultati hanno mostrato una riduzione significativa dei sanguinamenti con la sola ASA a 12 mesi: 50 eventi emorragici (15.1%) vs. 89 (26.6%), che diventano 50 (15.1%) vs. 83 (24.9%) analizzando i sanguinamenti non procedurali; RR 0.57 e 0.61 a favore di SAPT con ASA. In particolare, è degno di nota come i sanguinamenti maggiori (che corrispondono ai sanguinamenti BARC di grado 3a) abbiano avuto una incidenza 3 volte maggiore nel gruppo DAPT (7.5% vs. 2.4%, RR 0.32). I due endpoint secondari sono risultati non inferiori nel gruppo SAPT vs. DAPT. Lo stroke ischemico si è verificato con incidenza sovrapponibile tra i 2 gruppi (17 e 18 eventi rispettivamente per SAPT e DAPT, pari a una incidenza del 5.1% e del 5.4%). Interessante come l’endpoint secondario 1 (che potremmo definire beneficio clinico netto, combinazione di eventi emorragici e ischemici) sia risultato significativamente ridotto nel gruppo SAPT con una differenza assoluta di -8.2% (I.C. da -14.9% a – 1.5%). Nessuna differenza in merito alla mortalità totale e cardiovascolare.
Take home message
Nei pazienti sottoposti a TAVI e senza indicazione all’anticoagulazione, l’utilizzo di SAPT (solo ASA) ha ridotto il sanguinamento e l’endpoint combinato sanguinamento ed eventi tromboembolici rispetto a una DAPT (ASA e clopidogrel) per tre mesi.
Commento
La popolazione TAVI è anziana, spesso fragile, e caratterizzata da un rischio emorragico mediamente piuttosto elevato: nello studio appena esposto, i pazienti trattati con DAPT per 3 mesi sono andati incontro in ben 1 caso su 10 a un sanguinamento definito come maggiore, potenzialmente fatale o invalidante. Per questo motivo, la scelta di una SAPT piuttosto che della classica DAPT è interessante e il PopularTAVI ha rappresentato un necessario approfondimento. È importante citare a questo proposito lo studio GALILEO[5]Dangas GD, Tijssen JGP, Wohrle J, Sondergaard L, Gilard M, Mollmann H, et al. A Controlled Trial of Rivaroxaban after Transcatheter Aortic-Valve Replacement. N Engl J Med. 2020;382(2):120-9., interessante trial che ha analizzato l’effetto di rivaroxaban 10 mg in aggiunta ad ASA, quest’ultima per 3 mesi, vs. “classica” DAPT con ASA/clopidogrel per 3 mesi seguita da sola ASA in pazienti sottoposti a TAVI e senza indicazione a terapia anticoagulante orale. Lo studio è stato interrotto per eccesso di eventi avversi nel braccio con rivaroxaban, a dimostrazione del rischio emorragico elevato della popolazione TAVI che, anche in questo studio presentava un’età media di oltre 80 anni (superiore quindi ai trial registrativi sugli anticoagulanti diretti, per fare un esempio). L’obiettivo del GALILEO era indagare l’impatto di una terapia anticoagulante a bassa dose sul fenomeno della trombosi asintomatica dei lembi valvolari (fenomeno questo connesso a incidenza aumentata di ictus e disfunzione di protesi), sperimentando quindi una terapia più aggressiva rispetto allo standard of care. È importante sottolineare come, pur a fronte di un aumento netto dei sanguinamenti, nel gruppo ASA/rivaroxaban il fenomeno della trombosi dei lembi si sia ridotto drasticamente, come documentato dallo studio ancillare di imaging GALIELO-4D[6]De Backer O, Dangas GD, Jilaihawi H, Leipsic JA, Terkelsen CJ, Makkar R, et al. Reduced Leaflet Motion after Transcatheter Aortic-Valve Replacement. N Engl J Med. 2020;382(2):130-9.. Il PopularTAVI si è mosso invece in direzione opposta al GALILEO, sperimentando una terapia antitrombotica meno potente dello standard attuale. In base ai risultati del trial, possiamo affermare che la SAPT con ASA appare più sicura ed egualmente efficace rispetto alla DAPT nei pazienti TAVI. Tuttavia, il numero degli eventi ridotto rispetto a quanto previsto nel piano statistico del protocollo potrebbe minare l’attendibilità dei risultati in particolare relativamente alla protezione ischemica. Inoltre, in questo studio non è stato indagato l’impatto della terapia sulla funzione valvolare: non sono infatti disponibili dati relativi e dati ecografici sulle protesi come i gradienti e il tasso di leak all’impianto e al follow-up; il problema della trombosi asintomatica dei lembi rimane pertanto aperto.
L’opinione di Davide Capodanno
Dipartimento di Chirurgia Generale e Specialità Medico-Chirurgiche, Università di Catania
Lo studio POPular TAVI, relativo alla coorte di pazienti senza anticoagulazione orale, ha centrato i suoi due obiettivi primari (sanguinamento e sanguinamento non correlato alla TAVI) con probabilità assai basse (0.1% e 0.5%, rispettivamente) che questi risultati siano falsamente positivi. Sul piano statistico ciò appare convincente, anche se l’assunzione degli autori relativa al sanguinamento si è poi rivelata eccessiva (36% di eventi previsti nel gruppo di controllo contro il 27% osservato). Infatti, gli autori avevano comunque randomizzato ben più dei pazienti necessari per l’analisi del sanguinamento (primo obiettivo primario), al fine di consentire l’analisi del sanguinamento correlato alla TAVI (secondo obiettivo primario, per il quale l’assunzione si è poi rivelata corretta). Sul piano clinico, i benefici finali dei due obiettivi sono stimati attorno al 43% e al 39% in termini relativi e attorno all’11.5% e al 9.8% in termini assoluti (in linea con le attese, con un numero di pazienti da trattare per prevenire un sanguinamento di 9 e 10, rispettivamente). Questi numeri ci dicono che l’effetto della singola terapia antipiastrinica nel trial è stato non solo statisticamente significativo, ma anche clinicamente considerevole. Occorre, però adesso entrare nel merito specifico delle definizioni dei due obiettivi primari: il primo endpoint è un composito di sanguinamenti minori, maggiori, minacciosi per la vita o disabilitanti secondo la classificazione VARC, e la riduzione complessiva appare trainata da un beneficio significativo a carico dei sanguinamenti sia minori che maggiori, ma non dei sanguinamenti minacciosi per la vita o disabilitanti. Il secondo endpoint è meno convenzionale in quanto rappresentato da una definizione ad hoc di sanguinamenti non correlati alla procedura, da cui venivano esclusi i sanguinamenti BARC 4 (che in realtà si riferiscono tradizionalmente alla chirurgia cardiaca) e in cui venivano inclusi i sanguinamenti legati all’accesso vascolare. Gli Autori non segnalano particolari eterogeneità nell’effetto del trattamento derivanti dall’analisi dei sottogruppi. È interessante notare che in POPular TAVI il beneficio non è stato controbilanciato da un aumento del rischio di eventi tromboembolici, obiettivo che è stato analizzato con disegno di non inferiorità. Questo risultato però deve tenere conto del fatto che la dimensione del campione per l’obiettivo di non-inferiorità si basava su un composito di eventi emorragici e tromboembolici, e non sui molto meno frequenti eventi tromboembolici isolati. Ciò suggerisce che il trial è solido nel dimostrare che ASA da sola riduce i sanguinamenti e i sanguinamenti non correlati alla TAVI (un riscontro plausibile e poco sorprendente) ma meno solido nel convincere oltre ogni ragionevole dubbio della sicurezza di questo approccio rispetto agli eventi tromboembolici. Ciò detto, a fronte di percentuali molto simili di eventi tromboembolici nei due gruppi e in considerazione del fatto che i risultati si applicano a una popolazione grossomodo ottantenne, appare ragionevole concludere – bilanciando il ragionamento statistico e quello clinico – che ASA da sola dovrebbe rappresentare l’approccio di prima scelta nel contesto della TAVI in pazienti anziani che non assumono anticoagulanti orali.
Bibliografia[+]
| ↑1 | Baumgartner H, Falk V, Bax JJ, De Bonis M, Hamm C, Holm PJ, et al. 2017 ESC/EACTS Guidelines for the management of valvular heart disease. Eur Heart J. 2017;38(36):2739-91. |
|---|---|
| ↑2 | Nishimura RA, Otto CM, Bonow RO, Carabello BA, Erwin JP, 3rd, Fleisher LA, et al. 2017 AHA/ACC Focused Update of the 2014 AHA/ACC Guideline for the Management of Patients With Valvular Heart Disease: A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines. Circulation. 2017;135(25):e1159-e95. |
| ↑3 | Asgar AW, Ouzounian M, Adams C, Afilalo J, Fremes S, Lauck S, et al. 2019 Canadian Cardiovascular Society Position Statement for Transcatheter Aortic Valve Implantation. Can J Cardiol. 2019;35(11):1437-48. |
| ↑4 | Kappetein AP, Head SJ, Genereux P, Piazza N, van Mieghem NM, Blackstone EH, et al. Updated standardized endpoint definitions for transcatheter aortic valve implantation: the Valve Academic Research Consortium-2 consensus document. Eur Heart J. 2012;33(19):2403-18. |
| ↑5 | Dangas GD, Tijssen JGP, Wohrle J, Sondergaard L, Gilard M, Mollmann H, et al. A Controlled Trial of Rivaroxaban after Transcatheter Aortic-Valve Replacement. N Engl J Med. 2020;382(2):120-9. |
| ↑6 | De Backer O, Dangas GD, Jilaihawi H, Leipsic JA, Terkelsen CJ, Makkar R, et al. Reduced Leaflet Motion after Transcatheter Aortic-Valve Replacement. N Engl J Med. 2020;382(2):130-9. |
Accedi per leggere tutto l'articolo
Inserisci i dati del tuo account su Cardiotalk per accedere e leggere tutto il contenuto dell'articolo.
Se non hai un account, clicca sul pulsante registrati e verrai reindirizzato al portale Cardiotalk per la registrazione.

