Inquadramento
Le Linee Guida sulla rivascolarizzazione miocardica della Società Europea di Cardiologia[1]Neumann FJ, Sousa-Uva M, Ahlsson A, et al. 2018 ECS/EACTS guidelines on myocardial revascularization. Eur. Heart J. 2018. non raccomandano (Classe III livello di evidenza B) l’utilizzo routinario del contropulsatore aortico (IABP) nei pazienti con infarto miocardico acuto complicato da shock cardiogeno e sottoposti ad angioplastica coronarica (PCI), mentre non vi sono evidenze riguardo l’utilizzo di altri dispositivi di supporto circolatorio meccanico (DSM). Inoltre, queste Linee Guida non prendono in considerazione i pazienti stabili ma a elevato rischio procedurale (cosiddetti pazienti “CHIP”, cioè Complex High-risk Indicated Percutaneous Coronary Interventions). Le Linee Guida nordamericane[2]Levine GN, Bates ER, Blankenship JC, et al. 2011ACCF/AHA/SCAI guideline for percutaneous coronary intervention: a report of the American College of Cardiology Foundation/American Heart Association … Continua a leggere pongono l’utilizzo di dispositivi di supporto emodinamico nei pazienti ad alto rischio in classe IIb con livello di evidenza C, ma senza indicare quale dispositivo sia preferibile. Negli studi di confronto tra Impella e IABP nessuna differenza significativa è stata osservata[3]Ouweneel DM, Eriksen E, Sjauw KD, et al. Percutaneous mechanical circulatory support versus intra-aortic balloon pump in cardiogenic shock after acute myocardial infarction. J Am Coll Cardiol. … Continua a leggere[4]O’Neill WW, Kleiman NS, Moses J, et al. A prospective, randomized clinical trial of hemodynamic support with Impella 2.5 versus intraaortic balloon pump in patients undergoing high-risk … Continua a leggere, ma non esiste uno studio di confronto diretto tra Impella e assenza di DSM (“no-DSM”) nelle procedure complesse di PCI o nello shock cardiogeno.
Lo studio in esame
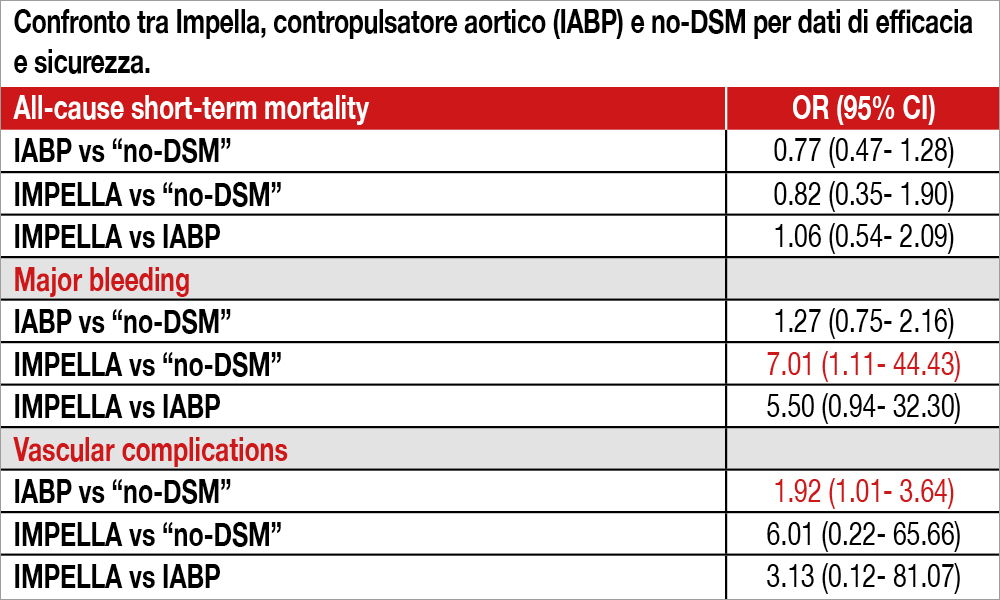
Sono stati identificati 9 studi randomizzati comprendenti globalmente 1.996 pazienti (262 pazienti trattati con Impella, 989 con IABP e 745 “no-DSM”; 6 studi in pazienti con infarto acuto con o senza shock, 3 studi in PCI elettive ad alto rischio). Inoltre sei studi confrontavano IABP e no-DSM, mentre tre studi confrontavano IABP e Impella. L’endpoint primario di efficacia era la mortalità totale intraospedaliera e a 30 giorni, mentre quello di sicurezza le complicanze emorragiche e vascolari. I risultati hanno mostrato che l’utilizzo sia dell’Impella che dell’IABP non ha prodotto differenze significative rispetto a “no-DSM” riguardo all’endpoint di efficacia, mentre l’utilizzo dell’Impella è risultato associato a un aumento significativo delle complicanze emorragiche e l’IABP di quelle vascolari. I risultati dei confronti diretti e indiretti, ottenuti con meta-analisi “network”, sono riportati nella Tabella.
Take home message
Non si è osservata alcuna riduzione di mortalità sia con IABP che con Impella rispetto a “no-DSM” in pazienti sottoposti a PCI ad alto rischio o per shock cardiogeno.
Interpretazione dei dati
Gli Autori sottolineano alcuni aspetti della analisi nella discussione del lavoro. Nella maggior parte degli studi è stato usato Impella 2.5, che avrebbe potuto non offrire una adeguata portata cardiaca, mentre ora è disponibile Impella 5 (che tuttavia necessita di un introduttore 23 French, anziché 13 French, esponendo il paziente a ulteriore rischio emorragico o di complicanze vascolari). Inoltre essi segnalano che in alcuni studi di pazienti in shock, Impella è stato inserito dopo PCI anziché preventivamente limitandone probabilmente i benefici. Vi è da osservare che la numerosità del campione analizzato globalmente è modesta e che di conseguenza gli intervalli di confidenza risultano molto ampi. Confortante la tendenza degli odds ratio a mostrare un beneficio di IABP e Impella nei confronti di una assenza di supporto, anche se non viene raggiunta la significatività statistica. Il maggior rischio emorragico e di complicanze con Impella impone ulteriori affinamenti tecnologici per ridurre le dimensioni del dispositivo.
L’opinione di Ferdinando Verbella
Direttore Dipartimento Medico e S.C. Cardiologia Rivoli Torino ASLTO3 Regione Piemonte, Responsabile Emodinamica ASLTO3 e Azienda Ospedaliera Universitaria San Luigi Orbassano (TO)
I punti di forza di questo studio sono rappresentati dalla numerosità dei pazienti, dalla rigorosa selezione dei lavori inclusi, tutti studi randomizzati, e dall’avere messo a confronto il trattamento con l’Impella e la terapia medica, su cui non sono stati pubblicati studi. I punti deboli, come gli stessi Autori hanno sottolineato, e che caratterizzano le metanalisi, sono l’eterogeneità nella definizione e della valutazione dei criteri d’inclusione e degli endpoint e l’assenza di analisi “patient level”: dati emodinamici, strategie di rivascolarizzazione adottate (trattamento solo del vaso colpevole o di tutti i vasi con stenosi critiche nella stessa procedura) e accesso vascolare (percutaneo o chirurgico a seconda del dispositivo utilizzato). Il punto debole principale di questo studio è però rappresentato dall’inclusione di 2 popolazioni assolutamente differenti tra di loro: da un lato pazienti in shock cardiogeno, e quindi con necessità di un supporto emodinamico atto a sostenere le funzioni vitali, dall’altro pazienti stabili e sottoposti a procedure elettive, per i quali il supporto emodinamico è utile per prevenire l’instabilità emodinamica durante interventi complessi. Considerando che lo shock cardiogeno è un processo che non dipende solo dall’insufficienza meccanica di pompa, ma coinvolge anche fattori ormonali e infiammatori[5]Reynolds HR, Hochman J. Cardiogenic shock: current concepts and improving outcomes. Circulation 2008; 117: 689-697., è improbabile che un dispositivo di assistenza ventricolare sinistra, per quanto sofisticato, possa da solo ridurre la mortalità in pazienti con shock refrattario alla terapia medica. Diverso è il contesto nei CHIP, dove l’assistenza ventricolare sinistra può prevenire l’instabilità emodinamica nelle PCI complesse e quindi può consentire di ottenere una rivascolarizzazione completa in una percentuale più alta di pazienti. Lo studio conferma, inoltre, i dati di un’analisi retrospettiva del registro cardiovascolare nazionale americano (NCDR) che ha utilizzato la metodica statistica “propensity score” su 1.600 pazienti che hanno evidenziato una più elevata frequenza di morte intraospedaliera (45% vs 34.1%) e di sanguinamenti maggiori (31.3% vs 16%) nel gruppo Impella rispetto al gruppo IABP[6]Dhruva SS, Ross JS, Mortazavi BJ, et al. Association of use of an intravascular microaxial left ventricular assist device vs intra-aortic balloon pump with in-hospital mortality and major bleeding … Continua a leggere. Sulla base delle conoscenze attualmente in nostro possesso possiamo concludere che, per la sua diffusione, la facilità di utilizzo, il basso costo e la relativa bassa frequenza di complicanze gravi, l’IABP mantiene ancora un ruolo centrale, ancorché con tutti i suoi limiti, nel trattamento di pazienti critici da sottoporre a PCI in condizioni di instabilità emodinamica o in pazienti ad alto rischio procedurale. L’Impella, nonostante possa produrre un’elevata portata cardiaca, per la mancanza di dati in letteratura, l’elevata potenzialità di produrre gravi complicanze emorragiche e per l’alto costo, può essere indicato in casi altamente selezionati, come per esempio gli shock refrattari alla terapia medica e all’IABP e gli shock non ischemici (miocardite fulminante, cardiopatia dilatativa non ischemica o tempeste aritmiche maligne) in centri di terzo livello.
Bibliografia[+]
| ↑1 | Neumann FJ, Sousa-Uva M, Ahlsson A, et al. 2018 ECS/EACTS guidelines on myocardial revascularization. Eur. Heart J. 2018. |
|---|---|
| ↑2 | Levine GN, Bates ER, Blankenship JC, et al. 2011ACCF/AHA/SCAI guideline for percutaneous coronary intervention: a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines and the Society for Cardiovascular Angiography and Interventions. Circulation. 2011; 124: e574-651. |
| ↑3 | Ouweneel DM, Eriksen E, Sjauw KD, et al. Percutaneous mechanical circulatory support versus intra-aortic balloon pump in cardiogenic shock after acute myocardial infarction. J Am Coll Cardiol. 2017;69:278-287. |
| ↑4 | O’Neill WW, Kleiman NS, Moses J, et al. A prospective, randomized clinical trial of hemodynamic support with Impella 2.5 versus intraaortic balloon pump in patients undergoing high-risk percutaneous coronary intervention: the PROTECT II study. Circulation. 2012;126:1717-1727. |
| ↑5 | Reynolds HR, Hochman J. Cardiogenic shock: current concepts and improving outcomes. Circulation 2008; 117: 689-697. |
| ↑6 | Dhruva SS, Ross JS, Mortazavi BJ, et al. Association of use of an intravascular microaxial left ventricular assist device vs intra-aortic balloon pump with in-hospital mortality and major bleeding among patients with acute myocardial infarction complicated by cardiogenic shock. JAMA 2020; 323:734-745. |
Accedi per leggere tutto l'articolo
Inserisci i dati del tuo account su Cardiotalk per accedere e leggere tutto il contenuto dell'articolo.
Se non hai un account, clicca sul pulsante registrati e verrai reindirizzato al portale Cardiotalk per la registrazione.

