Inquadramento
Lo studio Ablate and Pace for Atrial Fibrillation – Cardiac Resynchronization Therapy (APAF-CRT) è uno studio clinico randomizzato eseguito in pazienti con fibrillazione atriale (FA) permanente da più di 6 mesi, fortemente sintomatici, con durata del QRS ≤110 ms. Lo studio è stato condotto in 2 fasi. Nella prima fase dello studio, pubblicata nel 2018[1]Brignole M, Pentimalli F, Palmisano P, et al. AV junction ablation and cardiac resynchronization for patients with permanent atrial fibrillation and narrow QRS: the APAF-CRT mortality trial. Eur … Continua a leggere, 102 pazienti sono stati randomizzati in sequenza 1:1 ad ablazione del nodo-atrioventricolare (NAV) + terapia di cardioresincronizzazione (CRT) oppure a un semplice controllo farmacologico della frequenza cardiaca mediante terapia medica. In quello studio, braccio ablazione NAV+CRT aveva mostrato una riduzione delle ospedalizzazioni e della sintomatologia clinica relata allo scompenso cardiaco.
Lo studio in esame
Lo studio APAF-CRT mortality ha randomizzato ad ablazione NAV+CRT o a terapia medica, in sequenza 1:1, un totale di 133 pazienti affetti da FA permanente da più di 6 mesi, non candidabili ad ablazione della FA o con precedente ablazione fallita, fortemente sintomatici (uno o più episodi di scompenso cardiaco nell’ultimo anno), con durata del QRS ≤110 ms. Lo studio ha valutato l’impatto delle due diverse strategie, ablazione NAV+CRT vs terapia medica, sulla mortalità per tutte le cause. I criteri di esclusione erano: classe NHYA (New York Heart Association) IV, pressione arteriosa sistolica <80 mmHg in terapia medica ottimizzata, severe patologie non cardiache concomitanti, necessità di interventi chirurgici, recente infarto miocardico insorto entro 3 mesi e pregresso impianto di device: ovvero pazienti portatori di PMK/ICD/CRT che avevano una percentuale di stimolazione >5%, quelli con percentuale di stimolazione <5% erano stati arruolati.
L’età media dei pazienti era 72 anni (SD 11), la frazione di eiezione (FE) media era del 41% (SD 12) e il 47% dei pazienti erano donne. In totale, 63 pazienti sono stati assegnati al braccio ablazione NAV+CRT e 70 inclusi nel braccio terapia medica. Alla randomizzazione, la frequenza cardiaca media dei pazienti era 101 bpm (SD 23) nel braccio ablazione NAV+CRT e 103 bpm (SD 19) nel braccio terapia medica. La frequenza cardiaca media nel braccio terapia medica dopo 30 giorni di ottimizzazione della terapia medica era 65-90 bpm, mentre nel braccio ablazione NAV+CRT 70-75 bpm. Le modalità della terapia di resincronizzazione con o senza impianto di defibrillatore venivano definite in base a criteri standard riportati dalle Linee Guida.
In totale, 18 pazienti randomizzati alla terapia medica sono stati sottoposti a cross-over ad ablazione NAV+CRT, 16 dei quali in seguito al peggioramento dello scompenso cardiaco e 2 per decisione degli investigatori. L’endpoint primario dello studio era la mortalità per tutte le cause, mentre quello secondario il composito di mortalità per tutte le cause e ospedalizzazione per scompenso cardiaco.
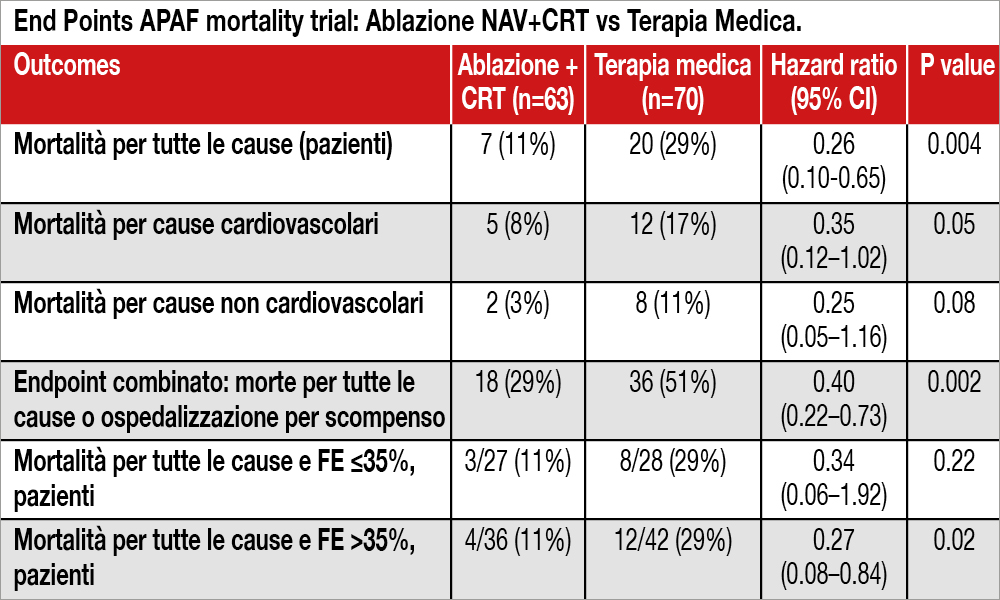
Lo studio è stato interrotto dopo 29 mesi di follow-up per eccesso di efficacia. Infatti, l’ablazione del NAV+CRT è risultata superiore alla terapia medica in termini di riduzione della mortalità per tutte le cause: [hazard ratio (HR) 0.26, 95% intervallo di confidenza (CI) 0.10–0.65; P=0.004]. I tassi di mortalità stimata a 4 anni erano del 14% nel braccio dell’ablazione + CRT, e del 41% e nel braccio della terapia medica. A 4 anni, le riduzioni del rischio relativo e assoluto erano rispettivamente del 74% e del 27% e il numero necessario di pazienti da trattare era di 3,7. L’ablazione del NAV+CRT ha ridotto in maniera significativa, rispetto alla terapia medica, l’endpoint combinato secondario mortalità per tutte le cause + ricovero ospedaliero per scompenso cardiaco: [18 (29%) vs. 36 (51%); HR 0.40, 95% CI 0.22–0.73; P=0.002].
Take home message
Nei pazienti con FA permanente da più di 6 mesi, con QRS stretto ≤110 ms, non portatori di device con stimolazione ≥5% e fortemente sintomatici per scompenso cardiaco, l’ablazione del NAV+CRT può ridurre la mortalità per tutte le cause e le ospedalizzazioni per scompenso cardiaco.
Interpretazione dei dati
Dobbiamo sottolineare che l’efficacia di questa strategia interventistica combinata non è da ascrivere solo al controllo della frequenza. Infatti, la frequenza media basale dei pazienti arruolati nello studio era discretamente ben controllata (101 bpm) e a 30 giorni dall’ottimizzazione della terapia medica era addirittura più bassa (65-90 bpm): nei pazienti del braccio terapia medica la mortalità a 4 anni non si riduce in maniera significativa nei soggetti con frequenza cardiaca <103 bpm, rispetto a quelli con frequenza cardiaca media >103 bpm, [hazard ratio HR=0.96 (96% CI 0.42-2.56)]. L’efficacia della strategia interventistica potrebbe essere quindi ascrivibile anche alla regolarizzazione dell’intervallo RR, con potenziale rimodellamento favorevole del ventricolo sinistro e riduzione delle pressioni di riempimento. Nella prima fase dello studio i pazienti che beneficiavano maggiormente della ablazione del NAV+CRT erano quelli con FE ≤35%. In questi ultimi l’HR relativo all’endpoint combinato mortalità per tutte le cause, ospedalizzazioni per scompenso cardiaco e peggioramento dello scompenso cardiaco è risultato pari a 0.18 (95% CI 0.05–0.66). In particolare, analizzando i sottogruppi prespecificati per disfunzione ventricolare sinistra, gli Autori hanno evidenziato un HR pari a 0.45 (95% CI 0.15–1.34) nei pazienti con FE 36–50% e 1.00 (95% CI 0.16–6.00) nei soggetti con FE>50%. Al contrario, nella seconda fase dello studio non sono state registrate differenze in termini di mortalità totale nel braccio ablazione NAV+CRT tra i pazienti con FE ≥35% e quelli con FE ≤35%. Questo aspetto suggerirebbe un maggiore ruolo prognostico avverso della irregolarità del ritmo nei pazienti con scompenso cardiaco e FA. Non è possibile mettere a confronto la strategia ablazione NAV+CRT con l’ablazione transcatetere della FA in questa tipologia di pazienti, perché lo studio CASTLE-AF, che ha analizzato l’ablazione di FA in pazienti con scompenso cardiaco e FE ridotta, ha arruolato soprattutto pazienti con FA parossistica o persistente, mentre nell’APAF-CRT la maggior parte dei pazienti aveva una FA permanente da più di 6 mesi[2]Marrouche NF, Brachmann J, Andresen D, et al.; for the CASTLE-AF Investigators. Catheter Ablation for Atrial Fibrillation with Heart Failure. N Engl J Med 2018; 378:417-27.. Si trattava quindi di pazienti non candidabili ad ablazione di FA, o nei quali tale strategia aveva fallito. Inoltre, i pazienti arruolati nel CASTLE AF erano più giovani di circa 8 anni e non vi erano pazienti con età al di sopra di 72 anni come nell’APAF-CRT. Nello studio CASTLE-AF la maggior parte dei pazienti era in classe NHYA II, mentre nell’APAF-CRT i pazienti erano caratterizzati da una condizione di scompenso cardiaco più avanzato (oltre il 67% in classe NHYA III). A seguito di questo studio, le Linee Guida della Società Europea di Cardiologia (ESC) 2021 hanno indicato l’ablazione del NAV+CRT come valida strategia terapeutica nei pazienti con scompenso cardiaco a frazione di eiezione (FE) ridotta, affetti da FA permanente e non candidabili ad ablazione della FA[3]2021 ESC Guidelines on cardiac pacing and cardiac resynchronization therapy. Developed by the Task Force on cardiac pacing and cardiac resynchronization therapy of the European Society of Cardiology … Continua a leggere.
L’opinione di Francesco Notaristefano e Claudio Cavallini
C.S.C. Cardiologia, Azienda Ospedaliera Perugia
Fibrillazione atriale e scompenso cardiaco sono associati da una relazione biunivoca dal momento che questa aritmia può essere conseguenza di una disfunzione ventricolare ma può anche esserne causa e determinare una tachicardiomiopatia[4]Wang TJ, Larson MG, Levy D, Vasan RS, Leip EP, Wolf PA, et al. Temporal relations of atrial fibrillation and congestive heart failure and their joint influence on mortality: the Framingham Heart … Continua a leggere. La terapia farmacologica ed elettrica dello scompenso cardiaco risulta meno efficace nei pazienti che presentano anche fibrillazione atriale e questo dato si aggiunge alla scarsa rappresentazione di questo sottogruppo di pazienti nei trial. Infatti, l’effetto di riduzione della mortalità che i beta bloccanti hanno dimostrato nei pazienti con scompenso cardiaco e in ritmo sinusale, non è evidente in coloro che hanno la fibrillazione atriale[5]Karwath A, Bunting KV, Gill SK, Tica O, Pendleton S, Aziz F, et al. Redefining beta-blocker response in heart failure patients with sinus rhythm and atrial fibrillation: a machine learning cluster … Continua a leggere e, allo stesso modo, la terapia di resincronizzazione cardiaca sembra offrire un beneficio minore[6]Ousdigian KT, Borek PP, Koehler JL, Heywood JT, Ziegler PD, Wilkoff BL. The epidemic of inadequate biventricular pacing in patients with persistent or permanent atrial fibrillation and its … Continua a leggere.
Per questo sono necessarie nuove armi per ridurre mortalità e morbidità di questi pazienti. Nei pazienti con scompenso cardiaco e FA lo studio CASTLE AF[7]Marrouche NF, Brachmann J, Andresen D, et al.; for the CASTLE-AF Investigators. Catheter Ablation for Atrial Fibrillation with Heart Failure. N Engl J Med 2018; 378:417-27. ha fornito una guida per i pazienti all’ablazione, mentre lo studio APAF CRT ha aperto un orizzonte interessante nei pazienti non candidati nè ad ablazione né formalmente a una terapia elettrica perché con QRS stretto. L’effetto della combinazione di ablazione del nodo e CRT in questo studio è stato sorprendente, ma non inaspettato. Infatti è noto come la fibrillazione atriale induca un rimodellamento elettrico e strutturale, sia a livello atriale che ventricolare generando o aggravando la disfunzione meccanica[8]Dobrev D, Friedrich A, Voigt N, Jost N, Wettwer E, Christ T, et al. The G protein-gated potassium current I(K,ACh) is constitutively active in patients with chronic atrial fibrillation. Circulation. … Continua a leggere[9]Ling LH, Kalman JM, Ellims AH, Iles LM, Medi C, Sherratt C, et al. Diffuse ventricular fibrosis is a late outcome of tachycardia-mediated cardiomyopathy after successful ablation. Circ Arrhythm … Continua a leggere[10]Gosselink AT, Blanksma PK, Crijns HJ, Van Gelder IC, de Kam PJ, Hillege HL, et al. Left ventricular beat-to-beat performance in atrial fibrillation: contribution of Frank-Starling mechanism after … Continua a leggere.
Tali meccanismi sono determinati non solo della frequenza cardiaca ma, soprattutto, dall’irregolarità del ritmo. Infatti è proprio questa variabilità negli intervalli fra le contrazioni miocardiche che genera una compromissione della perfusione miocardica che, a sua volta, potrebbe mediare gli effetti deleteri sulla funzione cardiaca[11]Wijesurendra RS, Liu A, Notaristefano F, Ntusi NAB, Karamitsos TD, Bashir Y, et al. Myocardial Perfusion Is Impaired and Relates to Cardiac Dysfunction in Patients With Atrial Fibrillation Both … Continua a leggere[12]Gasparini M, Steinberg JS, Arshad A, Regoli F, Galimberti P, Rosier A, et al. Resumption of sinus rhythm in patients with heart failure and permanent atrial fibrillation undergoing cardiac … Continua a leggere. Questo effetto positivo di regolarizzazione del ritmo era già emerso tramite la dimostrazione del ripristino spontaneo del ritmo sinusale in una quota, non trascurabile, di pazienti con FA permanente che venivano sottoposti a CRT e andavano incontro ad ablazione del nodo AV[13]Tops LF, Schalij MJ, Holman ER, van Erven L, van der Wall EE, Bax JJ. Right ventricular pacing can induce ventricular dyssynchrony in patients with atrial fibrillation after atrioventricular node … Continua a leggere.
Nell’APAF i benefici dell’eliminazione dell’irregolarità del ritmo sono stati ulteriormente potenziati dall’effetto protettivo sulla funzione ventricolare sinistra della stimolazione biventricolare, rispetto al pacing ventricolare destro determinando così una riduzione di mortalità rispetto alla terapia farmacologica. In conclusione, i dati dell’APAF e le altre evidenze disponibili indicano che nei pazienti con fibrillazione atriale e una frequenza superiore a 80 battiti per minuto, con disfunzione ventricolare e con ospedalizzazioni per scompenso, la regolarizzazione del ritmo mediante l’ablazione del nodo e la stimolazione biventricolare dovrebbero essere considerati come terapia di prima linea. Il dimostrato effetto di riduzione della mortalità dovrebbe eliminare la paura che, inconsciamente, si prova nell’indirizzare un paziente verso l’ablazione del nodo atrioventricolare.
Bibliografia[+]
| ↑1 | Brignole M, Pentimalli F, Palmisano P, et al. AV junction ablation and cardiac resynchronization for patients with permanent atrial fibrillation and narrow QRS: the APAF-CRT mortality trial. Eur Heart J 2018; 39, 3999–4008 |
|---|---|
| ↑2, ↑7 | Marrouche NF, Brachmann J, Andresen D, et al.; for the CASTLE-AF Investigators. Catheter Ablation for Atrial Fibrillation with Heart Failure. N Engl J Med 2018; 378:417-27. |
| ↑3 | 2021 ESC Guidelines on cardiac pacing and cardiac resynchronization therapy. Developed by the Task Force on cardiac pacing and cardiac resynchronization therapy of the European Society of Cardiology (ESC). Authors/Task Force Members: Michael Glikson (Chairperson) (Israel), Jens Cosedis Nielsen (Chairperson) (Denmark), Mads Brix Kronborg (Task Force Coordinator) (Denmark), Yoav Michowitz (Task Force Coordinator) (Israel), Angelo Auricchio (Switzerland), Israel Moshe Barbash (Israel), Jose´ A. Barrabe´s (Spain), Giuseppe Boriani (Italy), Frieder Braunschweig (Sweden), Michele Brignole (Italy), Haran Burri (Switzerland), Andrew J. S. Coats (United Kingdom), Jean-Claude Deharo (France), Victoria Delgado (Netherlands), Gerhard-Paul Diller (Germany), CarstenW. Israel (Germany), Andre Keren (Israel), Reinoud E. Knops(Netherlands), Dipak Kotecha (United Kingdom), Christophe Leclercq (France). European Heart Journal (2021) 00, 1-94. |
| ↑4 | Wang TJ, Larson MG, Levy D, Vasan RS, Leip EP, Wolf PA, et al. Temporal relations of atrial fibrillation and congestive heart failure and their joint influence on mortality: the Framingham Heart Study. Circulation. 2003;107(23):2920-5. |
| ↑5 | Karwath A, Bunting KV, Gill SK, Tica O, Pendleton S, Aziz F, et al. Redefining beta-blocker response in heart failure patients with sinus rhythm and atrial fibrillation: a machine learning cluster analysis. Lancet. 2021;398(10309):1427-35. |
| ↑6 | Ousdigian KT, Borek PP, Koehler JL, Heywood JT, Ziegler PD, Wilkoff BL. The epidemic of inadequate biventricular pacing in patients with persistent or permanent atrial fibrillation and its association with mortality. Circ Arrhythm Electrophysiol. 2014;7(3):370-6. |
| ↑8 | Dobrev D, Friedrich A, Voigt N, Jost N, Wettwer E, Christ T, et al. The G protein-gated potassium current I(K,ACh) is constitutively active in patients with chronic atrial fibrillation. Circulation. 2005;112(24):3697-706.6. Halperin HR, Nazarian S. Atrial fibrillation and diffuse left ventricular fibrosis, a causal association? J Am Coll Cardiol. 2012;60(23):2409-10. |
| ↑9 | Ling LH, Kalman JM, Ellims AH, Iles LM, Medi C, Sherratt C, et al. Diffuse ventricular fibrosis is a late outcome of tachycardia-mediated cardiomyopathy after successful ablation. Circ Arrhythm Electrophysiol. 2013;6(4):697-704. |
| ↑10 | Gosselink AT, Blanksma PK, Crijns HJ, Van Gelder IC, de Kam PJ, Hillege HL, et al. Left ventricular beat-to-beat performance in atrial fibrillation: contribution of Frank-Starling mechanism after short rather than long RR intervals. J Am Coll Cardiol. 1995;26(6):1516-21. |
| ↑11 | Wijesurendra RS, Liu A, Notaristefano F, Ntusi NAB, Karamitsos TD, Bashir Y, et al. Myocardial Perfusion Is Impaired and Relates to Cardiac Dysfunction in Patients With Atrial Fibrillation Both Before and After Successful Catheter Ablation. Journal of the American Heart Association. 2018;7(15):e009218. |
| ↑12 | Gasparini M, Steinberg JS, Arshad A, Regoli F, Galimberti P, Rosier A, et al. Resumption of sinus rhythm in patients with heart failure and permanent atrial fibrillation undergoing cardiac resynchronization therapy: a longitudinal observational study. Eur Heart J. 2010;31(8):976-83. |
| ↑13 | Tops LF, Schalij MJ, Holman ER, van Erven L, van der Wall EE, Bax JJ. Right ventricular pacing can induce ventricular dyssynchrony in patients with atrial fibrillation after atrioventricular node ablation. J Am Coll Cardiol. 2006;48(8):1642-8. |
Accedi per leggere tutto l'articolo
Inserisci i dati del tuo account su Cardiotalk per accedere e leggere tutto il contenuto dell'articolo.
Se non hai un account, clicca sul pulsante registrati e verrai reindirizzato al portale Cardiotalk per la registrazione.

