Inquadramento
La fibrillazione atriale (FA), rilevata all’ECG tradizionale in pazienti sintomatici, è un importante fattore di rischio per ictus cerebrale. In questi ultimi anni si sono accumulati studi che hanno dimostrato che anche gli episodi di FA asintomatica, rilevata da pacemakers o altri device a permanenza (CIEDs) siano predittivi di ictus cerebrale, sebbene con “potenza’ meno forte rispetto agli episodi di FA sintomatica rilevata tradizionalmente[1]Healey JS, Connolly SJ, Gold MR, et al. ASSERT Investigators. Subclinical atrial fibrillation and the risk of stroke. N Engl J Med. 2012;366(2):120-129. doi:10.1056/NEJMoa1105575.[2]Bertaglia E, Blank B, Blomström-Lundqvist C, et al. Atrial high-rate episodes: prevalence, stroke risk, implications for management, and clinical gaps in evidence. Europace. 2019;21(10):1459-1467. Tuttavia, non sono state riscontrate evidenze a supporto dell’ipotesi che l’ictus cerebrale sia temporalmente preceduto da episodi di FA subclinica.
Lo studio delle relazioni temporali tra episodi di FA, anche asintomatica, e insorgenza di ictus cerebrale è di estrema importanza per due motivi principali. Il primo motivo è di ordine fisiopatologico: l’eventuale dimostrazione di una qualche associazione temporale tra episodio di FA e insorgenza di ictus cerebrale, darebbe forza all’ipotesi tradizionale dell’ictus come possibile conseguenza diretta di un trombo sviluppatosi nel cuore durante la FA e successivamente distaccatosi (ipotesi dell’ictus cardio-embolico). Al contrario, l’eventuale assenza di tale associazione temporale potrebbe far pendere la bilancia verso l’ipotesi alternativa che vedrebbe FA e ictus cerebrale come co-fenomeni di una situazione patologica di base ad effetti sia proaritmici che pro-trombotici. Il secondo motivo, non meno importante, è di ordine terapeutico: nei pazienti portatori di CIEDs, nei quali si evidenzino episodi di FA asintomatica, è giusto somministrare farmaci anticoagulanti allo scopo di prevenire l’ictus? In altri termini, il beneficio sulla riduzione dell’ictus cerebrale in questi pazienti giustificherebbe il rischio emorragico legato alla terapia anticoagulante?
Gli studi finora disponibili hanno avuto il grosso limite della relativamente scarsa numerosità della casistica. Uno studio, eseguito solo in soggetti di sesso maschile portatori di defibrillatori impiantabili, ha suggerito un aumento del rischio di ictus cerebrale nei 30 giorni successivi all’insorgenza di FA subclinica di lunga durata[3]Turakhia MP, Ziegler PD, Schmitt SK, et al. Atrial fibrillation burden and short-term risk of stroke: case-crossover analysis of continuously recorded heart rhythm from cardiac electronic implanted … Continua a leggere.
Lo studio in esame
Si tratta di un’analisi inizialmente eseguita su 466.635 pazienti portatori di CIEDs, tra gennaio 2007 e marzo 2017, con strumenti in grado di monitorare permanentemente l’ECG. Da questi, sono stati selezionati i pazienti che rispondevano ai seguenti criteri:
- ricovero in ospedale per un primo episodio di ictus cerebrale, con conferma TC o RMN, che rappresentava la causa principale del ricovero;
- almeno 120 giorni di monitoraggio continuo dell’ECG prima dell’episodio di ictus cerebrale;
- informazioni sulla terapia assunta dal paziente all’atto del ricovero (includenti la terapia anticoagulante).
È stata eseguita una analisi definita come “single-patient cross-over’. Ogni paziente, in pratica, funge da controllo di sé medesimo. In dettaglio, gli Autori hanno esaminato, in ogni paziente, l’eventuale insorgenza di episodi di FA della durata di almeno 5,5 ore:
- nei 30 giorni prima dell’episodio di ictus (“case period’);
- tra il 91° e il 120° giorno prima dell’episodio di ictus (“control period’). L’insorgenza di FA nel “case period’, ma non nel “control period’ (reperto “informativo’), suggerirebbe un rapporto di causalità fisiopatologica tra FA e ictus (FA recente à trombo in auricolaàdistacco di tromboàembolo).
Al contrario, l’insorgenza di FA in entrambi i periodi, anche in quello molto antecedente all’ictus, non sarebbe ugualmente supportiva dell’ipotesi tromboembolica (reperto “non informativo’). È stata scelta una durata minima dell’episodio di FA di 5,5 ore perché risultata predittiva di aumentato rischio di ictus nello studio TRENDS[4]Glotzer TV, Daoud EG,Wyse DG, et al. The relationship between daily atrial tachyarrhythmia burden from implantable device diagnostics and stroke risk: the TRENDS study. Circ Arrhythm Electrophysiol. … Continua a leggere.
È stato calcolato l’Odds Ratio (OR) per ictus cerebrale degli episodi di FA prolungata (almeno 5,5 ore) nel confronto tra “case period’ e “control period’. È stata eseguita anche una analisi secondaria “spezzettando’ il “case period’ e il “control period’ in sottoperiodi (1-5 giorni, 6-10 giorni, 11-15 giorni, 16-20 giorni, 21-25 giorni e 26-30 giorni). È stato anche valutato se gli OR calcolati differivano (test per interazione) tra soggetti trattati e non trattati con farmaci anticoagulanti. Sono stati inclusi 891 pazienti rispondenti ai criteri di inclusione (ictus ischemico e precedente FA rilevata da CIEDs). L’età mediana era di 76 anni e il CHA2DS2VASc score mediano era pari a 4,9. Era presente ipertensione nell’80% dei pazienti, scompenso cardiaco nel 57% e pregresso ictus nel 52%. In totale, 825 pazienti (93%) hanno mostrato uno o più episodi di FA sia nel ‘case period’ che nel ‘control period’, risultando quindi ‘non informativi’. Inoltre, 143 pazienti hanno presentato almeno 1 episodio di FA, di almeno 5,5 ore in entrambi i periodi. Infine, ed è stato il dato più importante, 52 pazienti hanno mostrato 1 episodio di FA di almeno 5,5 ore nei 30 giorni prima dell’ictus, ma non nell’intervallo tra il 90° e il 120° giorno, mentre 14 pazienti hanno presentato FA di analoga durata nell’intervallo tra il 90° e il 120° giorno, ma non nei 30 giorni, prima dell’ictus. In pratica l’OR per ictus è stato pari a 3,71 (IC 95%: 2.06-6.70) nei pazienti con FA nei 30 giorni prima dell’ictus, ma non nell’intervallo tra il 90° e il 120° giorno, rispetto ai pazienti con assenza di FA recente, ma solo più antecedente. In altri termini, i pazienti con FA asintomatica nei 30 giorni prima dell’ictus, ma non tra il 90° e il 120° giorni prima, hanno mostrato una probabilità di fare ictus 3,71 volte maggiore dei pazienti con pattern opposto.
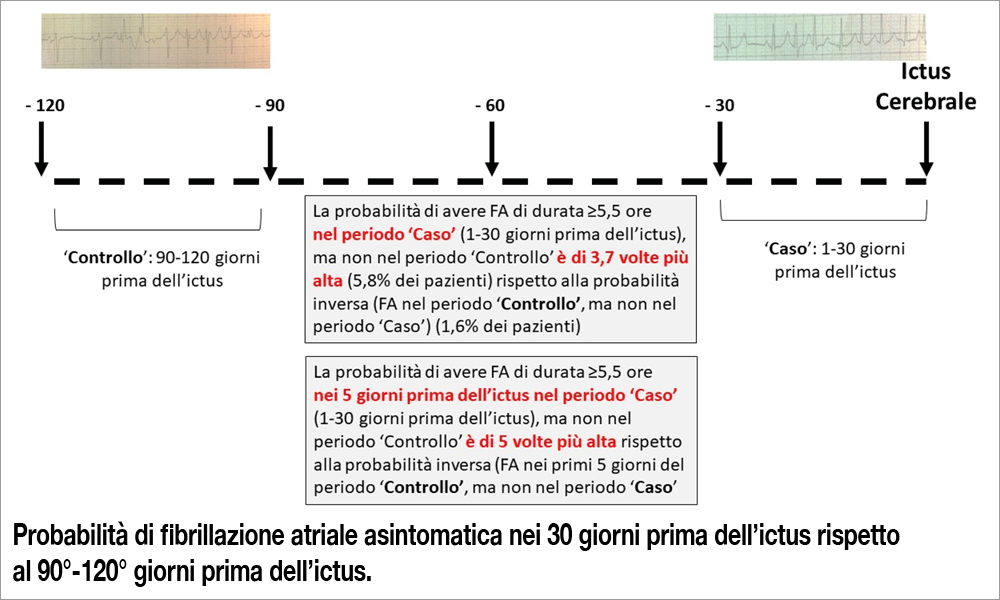
Ancora più interessante è stata l’analisi derivata dallo ‘spezzettamento temporale’ dei due sottoperiodi. I pazienti con FA asintomatica di durata di almeno 5,5 ore nel corso dei 5 giorni prima dell’ictus, ma non tra tra il 91° e il 95° giorno prima dell’ictus, hanno mostrato una probabilità di fare ictus ben 5,0 volte maggiore rispetto ai pazienti con pazienti con pattern opposto. Infine, confrontando i due gruppi di pazienti trattati o non trattati con terapia anticoagulante, gli Autori hanno notato un’interazione significativa (p=0.009) tra i due gruppi, sebbene si sia trattato di due gruppi di piccole dimensioni. In altri termini, la terapia anticoagulante tendeva ad annullare l’eccessivo aumento del rischio di ictus associato a una FA nei 30 giorni precedenti l’ictus. Nei pazienti non in terapia anticoagulante, il rischio associato a una FA precoce (1-30 giorni precedenti) era ancora più elevato (OR 7.80 (IC 90% 3.07-19.79)).
Take home message
I risultati di questo studio, eseguito su una casistica di vaste dimensioni suggeriscono che, in pazienti portatori di CIEDs, una FA silente di lunga durata (≥5,5 ore) aumenta il rischio di ictus cerebrale nei 30 giorni successivi (di 3,7 volte), e soprattutto nei 5 giorni successivi (di 5 volte) all’episodio di FA silente. Deve essere chiaro che il gruppo di controllo (quello con rischio di ictus rispettivamente 3,7 e 5 volte minore) era rappresentato da quei pazienti senza FA silente nei 30 giorni prima dell’ictus, ma con FA silente più ‘lontana’ nel tempo, ossia 90 giorni o più prima dell’insorgenza dell’ictus. Il secondo dato importante di questo studio è che tale aumento di rischio non si è osservato nei pazienti in terapia anticoagulante. La terapia anticoagulante potrebbe quindi ridurre o abolire l’impatto della FA silente sul rischio immediato di ictus.
Interpretazione dei dati
Questi risultati supportano l’ipotesi ‘tradizionale’ che l’ictus cerebrale in pazienti con FA sia di natura essenzialmente tromboembolica[5]Turakhia MP, Ziegler PD, Schmitt SK, et al. Atrial fibrillation burden and short-term risk of stroke: case-crossover analysis of continuously recorded heart rhythm from cardiac electronic implanted … Continua a leggere. Ancora più importante, i dati suggeriscono che il riscontro di episodi di FA asintomatica di durata superiore alle 5,5 ore, in pazienti portatori di CIEDs potrebbero indurre la necessità di un ciclo, anche di breve durata, di terapia anticoagulante. Questa importante ipotesi di lavoro merita ovviamente un trial prospettico randomizzato e controllato. Come tutti gli studi, anche questo soffre di alcune limitazioni. Si trattava di pazienti tutti portatori di CIEDs, e non sappiamo quindi fino a che punto i risultati siano estrapolabili alla popolazione generale. Inoltre, il disegno dello studio non ha consentito la stima esatta dell’incidenza di ictus cerebrale nei pazienti con e senza episodi di FA.
L’opinione di Francesco Notaristefano
Cardiologia, Perugia
La Fibrillazione Atriale (FA) aumenta di circa 5 volte il rischio di stroke[6]Hindricks G, Potpara T, Dagres N, Arbelo E, Bax JJ, Blomstrom-Lundqvist C, et al. 2020 ESC Guidelines for the diagnosis and management of atrial fibrillation developed in collaboration with the … Continua a leggere. Tuttavia, tale incremento di rischio non è omogeneo. Infatti, a parte i differenti fattori inclusi nel CHA2DS2VASc che contribuiscono a determinare il rischio di stroke, c’è anche un effetto del tipo di aritmia e dei sintomi a questa correlati. La FA subclinica è quella, generalmente asintomatica, rilevata con i device impiantabili e si contrappone a quella clinica che, invece, è registrata con un ECG di superficie[7]Camm AJ, Simantirakis E, Goette A, Lip GY, Vardas P, Calvert M, et al. Atrial high-rate episodes and stroke prevention. Europace. 2017;19:169-79.. La forma subclinica sembra essere associata a un rischio inferiore di stroke ma, tuttavia, non esistono solidi dati per la gestione di questi pazienti a differenza di coloro che rientrano nel gruppo “FA clinica’. La FA subclinica non è un evento raro dal momento che l’incidenza può arrivare fino al 70% nei portatori di device. Il rischio di stroke, sebbene più basso che nei pazienti con FA clinica, sembra essere tanto più alto quanto maggiore è la durata degli episodi. In presenza di almeno un fattore di rischio per stroke, gli episodi della durata superiore a 1 ora sembrano raddoppiare il rischio di stroke, anche se altri studi hanno identificato 24 ore come cut-off per avere un incremento della probabilità di stroke tale da giustificare l’inizio della terapia anticoagulante[8]Boriani G, Glotzer TV, Santini M, West TM, De Melis M, Sepsi M, et al. Device-detected atrial fibrillation and risk for stroke: an analysis of >10,000 patients from the SOS AF project (Stroke … Continua a leggere.
Ma il dato ancora più interessante è stato l’apparente assenza di relazione temporale tra FA subclinica rilevata con il device ed evento ischemico cerebrale. Questi dati hanno messo alla prova l’ipotesi tradizionale che lega la FA clinica e lo stroke, ovvero la nozione della formazione di un trombo in auricola durante l’evento aritmico e la successiva embolizzazione a livello cerebrale [9]Brambatti M, Connolly SJ, Gold MR, Morillo CA, Capucci A, Muto C, et al. Temporal relationship between subclinical atrial fibrillation and embolic events. Circulation. 2014;129:2094-9; Daoud EG, … Continua a leggere.
Per questo, sono state avanzate ipotesi per cui lo stroke e la fibrillazione atriale non sarebbero altro che l’espressione di una patologia sistemica con un background infiammatorio, espressione a sua volta dei fattori di rischio come diabete e ipertensione[10]Wijesurendra RS, Casadei B. Mechanisms of atrial fibrillation. Heart. 2019;105:1860-7.. Lo studio qui analizzato riporta a un ruolo centrale la relazione temporale fra aritmia e stroke, infatti i pazienti con FA subclinica di almeno 5,5 ore, registrati dal device nei 30 giorni precedenti l’evento ischemico, avevano un rischio quasi 4 volte superiore rispetto a coloro che avevano episodi remoti. Questi dati potrebbero aprire la porta all’anticoagulazione “pill in the pocket’ per i pazienti il cui device registra episodi di FA. Come è possibile conciliare dati apparentemente così discordanti e quale futuro per l’anticoagulazione in questi pazienti? In primo luogo occorre ricordare come gli episodi registrati dal device non siano sempre FA. In questo gruppo, definito come Atrial High Rate Epiodes (AHRE) confluiscono anche episodi di flutter e di tachicardia atriale. Questo da un lato spiega il rischio ischemico inferiore della FA subclinica, ma anche la possibile assenza di stroke nelle immediate vicinanze dell’episodio perché non si trattava effettivamente di un episodio di FA. Inoltre, non tutti gli stroke dei pazienti con FA sono cardioembolici e quindi uno stroke può non essere preceduto dall’aritmia, perché in realtà non sono legati da un punto di vista fisiopatologico. Infine, per quanto riguarda l’anticoagulante, è bene ricordare che 1 paziente su 5 con FA subclinica svilupperà FA clinica nei 2 anni successivi e quindi, probabilmente, una strategia anticoagulante on/off guidata dagli episodi non potrà essere praticata dal momento che AHRE e FA clinica non sono entità differenti, ma rappresentato il risultato della nostra aumentata capacità diagnostica preventiva[11]Healey JS, Connolly SJ, Gold MR, et al. ASSERT Investigators. Subclinical atrial fibrillation and the risk of stroke. N Engl J Med. 2012;366(2):120-129. doi:10.1056/NEJMoa1105575.. In conclusione, gli interessanti dati emersi da questo studio indicano che il concetto di relazione temporale fra FA e stroke deve essere mantenuto, ma allo stesso modo stroke e FA possono coesistere nello stesso paziente senza un rapporto di causa-effetto, ma come il risultato di diversi fattori di rischio. Proprio per questa ragione, i tradizionali fattori di rischio dovrebbero restare ancora centrali nella scelta della terapia anticoagulante a lungo termine dal momento che un approccio guidato dagli eventi appare, a oggi, non supportato da adeguate evidenze soprattutto in relazione alla sua sicurezza per l’assenza di un validato timing di start e stop.
Bibliografia[+]
| ↑1, ↑11 | Healey JS, Connolly SJ, Gold MR, et al. ASSERT Investigators. Subclinical atrial fibrillation and the risk of stroke. N Engl J Med. 2012;366(2):120-129. doi:10.1056/NEJMoa1105575. |
|---|---|
| ↑2 | Bertaglia E, Blank B, Blomström-Lundqvist C, et al. Atrial high-rate episodes: prevalence, stroke risk, implications for management, and clinical gaps in evidence. Europace. 2019;21(10):1459-1467 |
| ↑3, ↑5 | Turakhia MP, Ziegler PD, Schmitt SK, et al. Atrial fibrillation burden and short-term risk of stroke: case-crossover analysis of continuously recorded heart rhythm from cardiac electronic implanted devices. Circ Arrhythm Electrophysiol. 2015;8(5): 1040-1047. doi:10.1161/CIRCEP.114.003057. |
| ↑4 | Glotzer TV, Daoud EG,Wyse DG, et al. The relationship between daily atrial tachyarrhythmia burden from implantable device diagnostics and stroke risk: the TRENDS study. Circ Arrhythm Electrophysiol. 2009;2:474-480. doi:10.1161/ CIRCEP.109.8496. |
| ↑6 | Hindricks G, Potpara T, Dagres N, Arbelo E, Bax JJ, Blomstrom-Lundqvist C, et al. 2020 ESC Guidelines for the diagnosis and management of atrial fibrillation developed in collaboration with the European Association of CardioThoracic Surgery (EACTS). Eur Heart J. 2021;42:373-498. doi: 10.1093/eurheartj/ehaa612. 2020 |
| ↑7 | Camm AJ, Simantirakis E, Goette A, Lip GY, Vardas P, Calvert M, et al. Atrial high-rate episodes and stroke prevention. Europace. 2017;19:169-79. |
| ↑8 | Boriani G, Glotzer TV, Santini M, West TM, De Melis M, Sepsi M, et al. Device-detected atrial fibrillation and risk for stroke: an analysis of >10,000 patients from the SOS AF project (Stroke preventiOn Strategies based on Atrial Fibrillation information from implanted devices). Eur Heart J. 2014;35:508-16 |
| ↑9 | Brambatti M, Connolly SJ, Gold MR, Morillo CA, Capucci A, Muto C, et al. Temporal relationship between subclinical atrial fibrillation and embolic events. Circulation. 2014;129:2094-9; Daoud EG, Glotzer TV, Wyse DG, Ezekowitz MD, Hilker C, Koehler J, et al. Temporal relationship of atrial tachyarrhythmias, cerebrovascular events, and systemic emboli based on stored device data: a subgroup analysis of TRENDS. Heart Rhythm. 2011;8:1416-23. |
| ↑10 | Wijesurendra RS, Casadei B. Mechanisms of atrial fibrillation. Heart. 2019;105:1860-7. |
Accedi per leggere tutto l'articolo
Inserisci i dati del tuo account su Cardiotalk per accedere e leggere tutto il contenuto dell'articolo.
Se non hai un account, clicca sul pulsante registrati e verrai reindirizzato al portale Cardiotalk per la registrazione.

